総括班
| 研究代表者 | 松崎 政紀(東京大学・教授) |
|---|---|
| 研究分担者 | 春野 雅彦(情報通信研究機構・室長) 井上 謙一(京都大学・助教) 田中 康裕(玉川大学・教授) 中江 健(福井大学・准教授) 尾藤 晴彦(東京大学・教授) 喜多村 和郎(山梨大学・教授) |
| 研究協力者 | Aurelio Cortese(ATR脳情報通信総合研究所・室長) 石田 綾(理化学研究所・チームリーダー) 山川 宏(東京大学・主幹研究員) |
計画研究班
A01 行動変容の広域脳動態
研究項目A01「社会行動の行動変容を生む脳ダイナミクスの解読と操作」
代表者:春野 雅彦(情報通信研究機構・室長)
メンバー
| 代表者 | 春野 雅彦(情報通信研究機構・室長) |  |
|---|---|---|
| 研究分担者 | 渡邉 慶(大阪大学・助教) | |
| 研究協力者 | 榎本 一紀(情報通信研究機構・研究員) 田中 敏子(情報通信研究機構・研究員) Zhang Qiang(情報通信研究機構・協力研究員(大学院生)) 藤野 美沙子(情報通信研究機構・協力研究員(大学院生)) Pranav Sankhe(情報通信研究機構・協力研究員) |
|
研究内容の概要
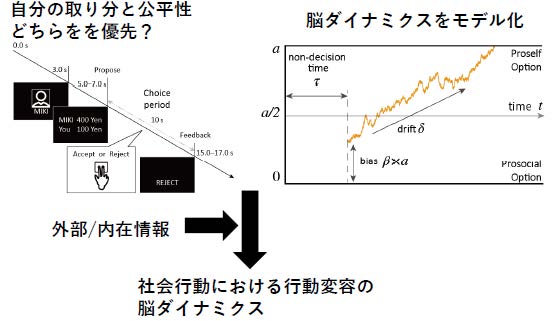
社会における行動変容の意味は大きい。しかしヒトが外部あるいは内在情報に基づき行動変容を起こす脳ダイナミクス、特に、外側/内側前頭葉、島皮質と、扁桃体/線条体/海馬といった皮質下領域の相互作用機序は未知の部分が多い。本研究では、1)社会行動中のヒトが、複数の競合するゴールから各自が重視する項目を選択、意思決定する際の脳ダイナミクスを解明し、2)外部、内在情報(例:他者との関係、XRによる刺激)に応じて行動変容を生む脳ダイナミクスを、顔面表出、皮膚温度など自律神経活動、SNS情報などに基づく多次元脳動態解析で明らかにする。さらに、3) 深部刺激が可能なdouble-cone coilによるTMSと収束超音波刺激を用いた脳活動操作実験により、脳ダイナミクスと行動変容の因果関係の同定をめざす。
文献
- Tanaka T, Okamoto N, Kida I, Haruno M. (in press) The initial decrease in 7T-BOLD signals detected by hyperalignment contains information to decode facial expressions. NeuroImage.
- Nihonsugi T, Tanaka T, Haruno M. (2021) Functional connectivity basis and underlying cognitive mechanisms for gender differences in guilt aversion. eNeuro 8, 0226-21.
- Ganesh G. Minamoto T. Haruno M. (2019) Activity in the dorsal ACC causes deterioration of sequential motor performance due to anxiety. Nature Communications 10, 4287.
研究項目A01「Metacognitive control of the neural signals that shape behaviour changes」
代表者:Aurelio Cortese(ATR脳情報通信総合研究所・室長)
メンバー
| 代表者 | Aurelio Cortese(ATR脳情報通信総合研究所・室長) |  |
|---|---|---|
| 研究分担者 | 川人 光男(ATR脳情報通信総合研究所・所長) |
|
| 研究協力者 | 外山 敬介(ATR脳情報通信総合研究所・招聘研究員) Huu Hoang(ATR脳情報通信総合研究所・研究員) |
|
研究内容の概要
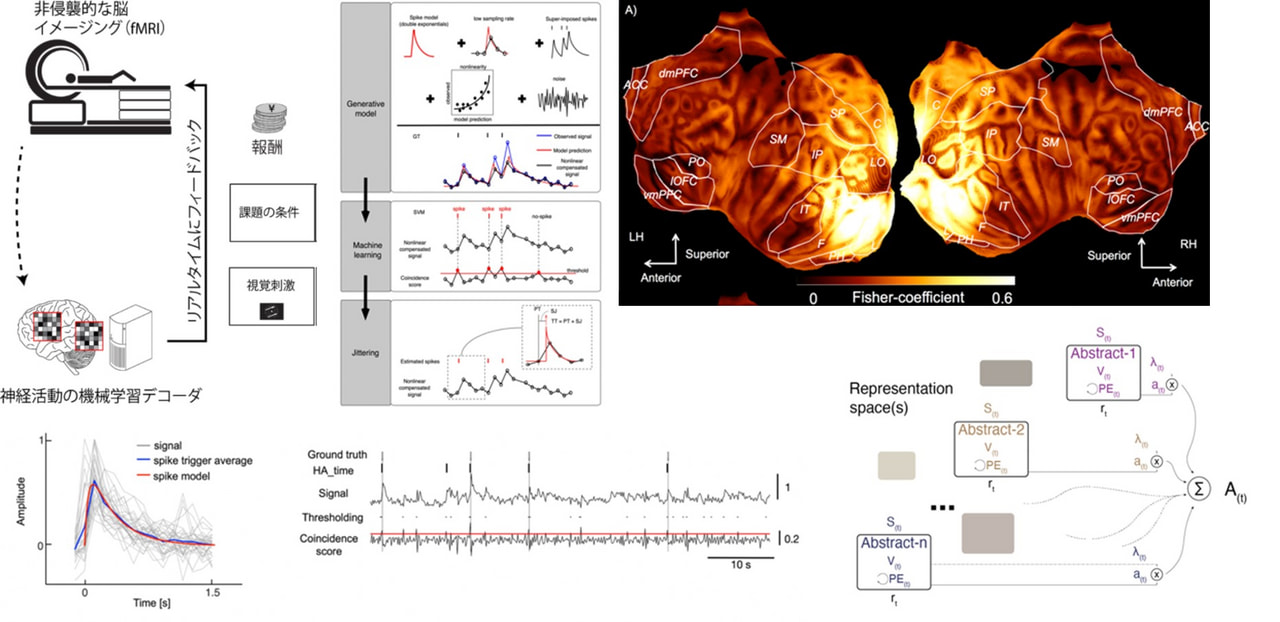
The goal of our group is to understand the neural dynamics and computational mechanisms of efficient behaviour change. The brain has a sophisticated mechanism for monitoring internal representations and changing behaviour. Metacognition is the ability to evaluate our own thoughts or performance, and in the lab, it is often measured as confidence reports. Our group studies the broader functions of metacognition with a focus on the interaction with learning and choice. We are particularly interested in the precise neural dynamics of these functions, which we believe provide an algorithmic basis to govern adaptive behaviour (and generate meaningful behaviour changes). In our research we use a combination of carefully crafted decision-making tasks, neuroimaging (fMRI in humans, calcium imaging in rodents) and computational models. In order to reach beyond current experimental limitations, we capitalise on a novel technique we developed –decoded neurofeedback. This technique allows us to causally change behaviour in targeted directions by reinforcing abstract neural representations. A major advance will be to implement decoded neurofeedback in rodents with real-time feedback of calcium imaging. Beyond confidence self-reports (in humans), we also record eye movement patterns, choices, reaction time and in rodents licking patterns and orofacial movements. This way, besides directly inducing behaviour changes through targeted neural reinforcement, we will shed light on how metacognition controls the goal-relevant neural representations that lead to efficient behaviour change.
文献
- Cortese A et al. (2021) Value signals guide abstraction during learning. eLife 10, e68943.
- Cortese A, Lau H, Kawato M. (2020) Unconscious reinforcement learning of Hhdden brain states supported by confidence. Nature Communications 11, 4429.
- Hoang H et al. (2020) Improved hyperacuity estimation of spike timing from calcium imaging. Scientific Reports 10, 17844.
研究項目A01「行動変容を支える広域脳ネットワークの構造解明とその制御」
代表者:井上 謙一(京都大学・助教)
メンバー
| 代表者 | 井上 謙一(京都大学・助教) |  |
|---|---|---|
| 研究分担者 | 松本 惇平(富山大学・助教) | |
| 研究協力者 | 兼子 峰明(京都大学・特定助教) | |
研究内容の概要
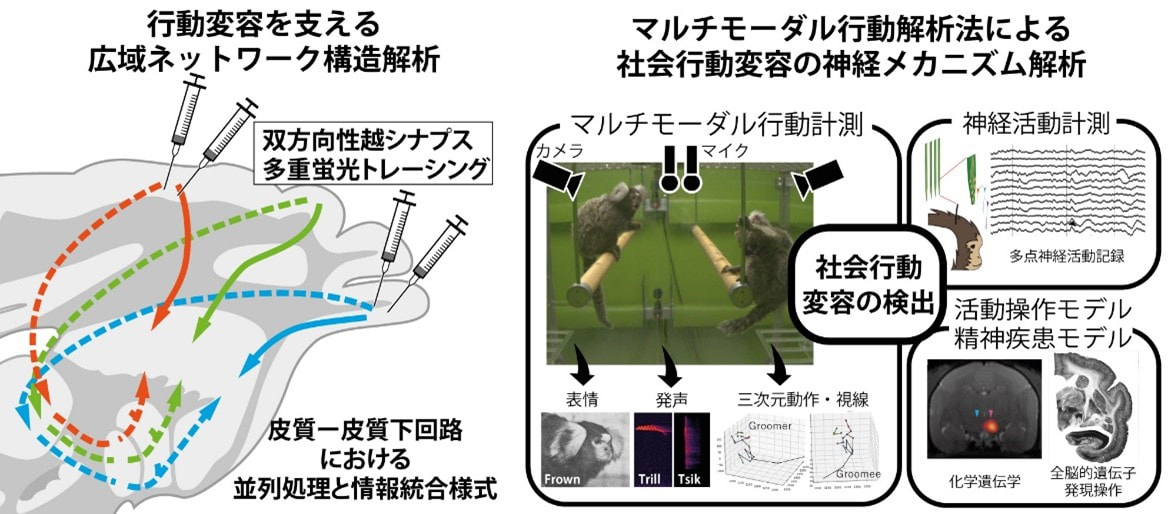
本研究では、独自に開発した多重蛍光越シナプストレーシング法やAIを活用した自動ラベル解析法を駆使し、行動の強化に関わる大脳皮質―大脳基底核ループ回路を中心に、内的欲求と理性的・社会的判断などが絡み合う行動変容に関わる広域神経ネットワーク回路構造について、情報統合パターンを含むその構築様式を解析します。また、AIを利用した霊長類のマルチモーダル行動解析法により、自然行動から社会行動変容を検出・評価するシステムを開発し、社会行動変容に関わるニューロン活動記録を行うとともに、遺伝子導入・操作による活動操作モデルや精神疾患モデルの解析から、ネットワーク状態変化と社会行動変容との関係性を調べます。これらの研究により、行動変容を支える広域脳内ネットワークの構成とその協調動作原理を明らかにすることを目指します。また、行動変容ネットワークの各コンポーネントの活動を選択的に計測する技術を開発し、領域内連携によって行動変容中の脳動態を効率良く検出する方法の確立に取り組みます。
文献
- Labuguen R et al. (2021) MacaquePose: A novel ‘in the wild’ macaque monkey pose dataset for markerless motion capture. Front Behav Neurosci 14, 581154.
- Ishida H#, Inoue K#, Takada M, Hoshi E. (#equally contributed). (2016) Origins of multisynaptic projections from the basal ganglia to the forelimb region of the ventral premotor cortex in macaque monkeys. Eur J Neurosci 43, 258-69.
- Inoue K, Takada M, Matsumoto M. (2015) Neuronal and behavioral modulations by pathway-selective optogenetic stimulation of the primate oculomotor system. Nature Communications 6, 8378.
研究項目A01「発達とその障害における行動変容と広域脳動態の解明」
代表者:石田 綾(理化学研究所・チームリーダー)
メンバー
| 代表者 | 石田 綾(理化学研究所・チームリーダー) |  |
|---|---|---|
| 研究協力者 | 柴田 明子(理化学研究所・特別研究員) | |
研究内容の概要
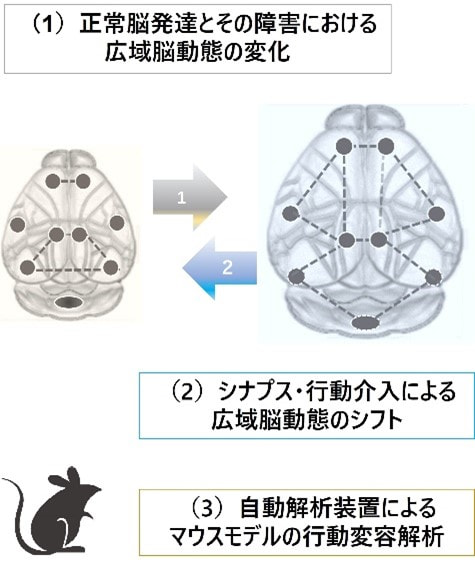
生まれたばかりの乳児の行動は、時々刻々と変容し多彩な機能を獲得する。発達に伴う行動変容は、広域ネットワークの動態に支えられるが、その実態については未解明な点が多い。代表者は正常脳発達に必須であるシナプス分子の役割を見出し、神経発達障害Rett症候群の分子病態を明らかにしてきた。そこで本研究では(1) 発達を支える広域脳動態の時空間変化を全脳イメージングにより捉え、発達障害モデルマウスでの変化を同定する。(2)「発達変容ネットワーク」と「障害感受性ネットワーク」を人為的にシフトする方法を考案する。局所シナプス変化と広域脳動態の相互関係を明らかにし、ネットワークへの介入を試みる。また、Rett症候群モデルマウスでは行動介入により発症を軽減できるとの報告を踏まえ、広域脳動態への影響を明らかにする。(3)行動変容と脳動態の関係性を明らかにするため、自動行動解析装置を用い、マウスの高次脳機能を解析する。発達とその障害における広域脳動態を明らかにし行動変容の理解と制御につなげる。
文献
- Ito-Ishida A* et al. (*co-corresponding authors) (2020) MeCP2 levels regulate the 3D structure of heterochromatic foci in mouse neurons. Journal of Neuroscience. 40, 8746-8766.
- Ito-Ishida A et al. (2018). Genome wide distribution of linker histone H1.0 is independent of MeCP2.” Nature Neuroscience 21, 794-798.
- Ito-Ishida A et al. (2015) Loss of MeCP2 in parvalbumin-and somatostatin-expressing neurons in mice leads to distinct Rett Syndrome-like phenotypes. Neuron 88, 651-8.
研究項目A01「脳参照アーキテクチャを用いた行動変容の分析」
代表者:山川 宏(東京大学・主幹研究員)
メンバー
| 代表者 | 山川 宏(東京大学・特任研究員) |  |
|---|---|---|
| 研究分担者 | 田和辻 可昌(東京大学・特任助教) 谷口 彰(立命館大学・講師) |
|
| 研究協力者 | 高橋 恒一(理化学研究所・チームリーダー) | |
研究内容の概要
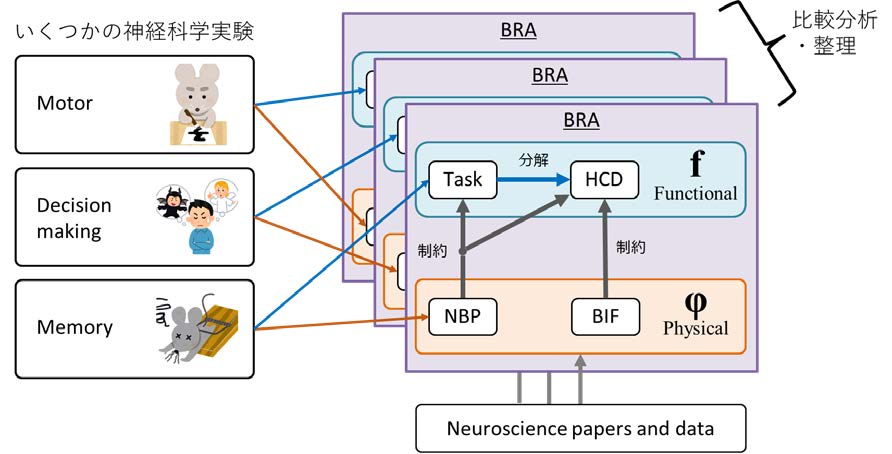
本研究では、他班が行った神経科学実験について、解剖学的構造や神経活動現象を計算機能に関連付ける分析を標準化されたデータ形式を用いて行う。まず着目脳領域(ROI)内のメゾスコピックレベルの解剖学的構造を抽出し、脳情報フロー(BIF)と呼ばれるデータ形式として格納する。次にBIF に沿った形で、特定の行動変容において、生体にとっての課題(Task)を解決するために必要な機能を体系的に分解した仮想コンポーネント図(HCD)を、神経科学実験で得られた神経活動(NBP)を参照しながら製作する。ここで、BIF、NBP、HCD を組み合わせたデータ形式を脳参照アーキテクチャ(BRA)と呼ぶ。なお、BRA に基づいて構築された計算モデルの振る舞いと、一部の実験で得られたNBP の挙動を比較することで、BRA の妥当性を検証する。そして、BRA として登録された複数の行動変容の脳科学的メカニズムの共通点と相違点を比較・分析・整理することで、個々の神経科学実験を超えた普遍性の高い知識の共有を促進する。さらに行動変容を促進する環境(仕掛け・ナッジなど)を設計するための構築論を検討する。
文献
- Yamakawa H. (2021) The whole brain architecture approach: Accelerating the development of artificial general intelligence by referring to the brain. Neural Networks: The Official Journal of the International Neural Network Society 144, 478–495.
- Taniguchi A, Fukawa A, Yamakawa H. (2022) Hippocampal formation-inspired probabilistic generative model. Neural Networks: The Official Journal of the International Neural Network Society 151, 317–335.
- Yamakawa, H. (2020) Revealing the computational meaning of neocortical interarea signals. Frontiers in Computational Neuroscience 14, 74.
A02 行動変容の広域-局所脳動態
研究項目A02「行動変容の基盤となる認知・記憶回路動態の解明」
代表者:松崎 政紀(東京大学・教授)
メンバー
| 代表者 | 松崎 政紀(東京大学・教授) |  |
|---|---|---|
| 研究分担者 | 尾藤 晴彦(東京大学・教授) 節家 理恵子(理化学研究所・研究員) |
|
研究内容の概要
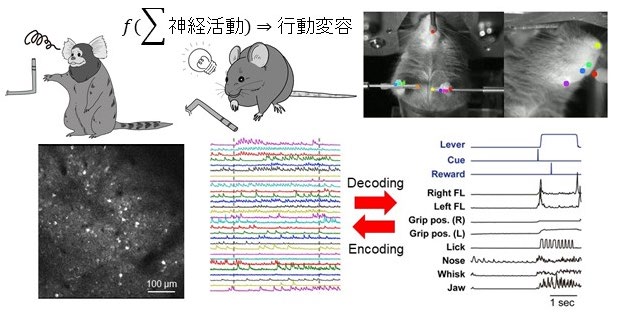
報酬確率とコストなどを組み合わせることで、葛藤が起こる行動変容課題をマウスとマーモセットに実行させ、同時に大脳皮質広域カルシウムイメージングや各領域での2光子カルシウムイメージングを行う。これにより、行動変容時、変容前後、その履歴に関わる脳動態を明らかにする。同時に計測した高次元行動データから行動変容時、変容前後、その履歴に関わる低次元行動変容を抽出して、脳動態と行動変容の関連性をマウスとマーモセットで説明できる強化学習モデルを構築する。マウスのカルシウムイメージングでは、連合記憶、価値、意思決定に関わる大脳皮質に加えて、大脳基底核の信号を大脳皮質へ伝達する視床皮質軸索活動を計測・解析することで、異なったネットワーク間の活動動態を明らかにし、記憶、意思決定から運動発現に至る脳動態の解明を目指す。
文献
- Kondo M, Matsuzaki M. (2021) Neuronal representations of reward-predicting cues and outcome history with movement in the frontal cortex. Cell Reports 34, 108704.
- Terada S et al. (2018) Super-wide-field two-photon imaging with a micro-optical device moving in post-objective space. Nature Communications 9, 3550.
- Tanaka YH et al. (2018) Thalamocortical axonal activity in motor cortex exhibits layer-specific dynamics during motor learning. Neuron 100, 244-258.
研究項目A02「行動変容の表出を規定する運動回路動態の解明」
代表者:喜多村 和郎(山梨大学・教授)
メンバー
| 代表者 | 喜多村 和郎(山梨大学・教授) |  |
|---|---|---|
| 研究分担者 | 山﨑 匡(電気通信大学・准教授) | |
研究内容の概要
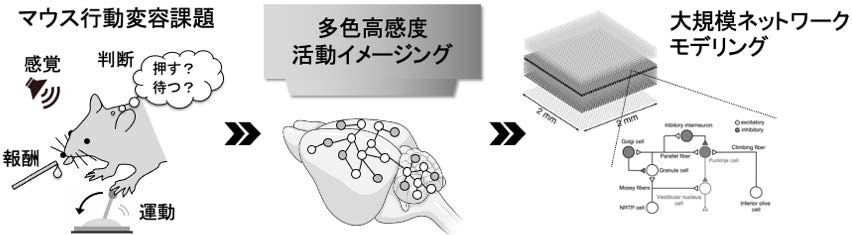
行動には必ず運動が伴い、行動変容は最終的には運動変化として表出される。代表者らは、運動の制御や学習に必須な脳構造である小脳に着目し、その多様な情報表現をこれまでに明らかにしてきた。さらに大脳と小脳の間の活動連関を生きたマウスで計測する方法を開発している。そこで本研究では、マウスが周囲の状況に応じて行動を変容させる課題を実行中に、課題行動のみならず顔面運動や全身運動をモニターして課題の学習と相関して変容する特徴的な低次元行動を抽出する。それと同時に1)広視野マクロカルシウムイメージングにより小脳および大脳皮質の神経ネットワーク活動を同時にイメージングすることによって計測し、大脳−小脳連関と行動変容の関係を明らかにする(喜多村)。さらに2)小脳および大脳における行動変容の情報表現を2光子カルシウムイメージングにより細胞レベルで明らかにする(喜多村)。3)得られたデータをもとに、スーパーコンピュータによる大規模神経回路シミュレーションを行い(山﨑)、行動変容の表出を担う運動回路動態の全貌を解明する。
文献
- Manita S, Ikezoe K, Kitamura K. (2022) A novel device of reaching, grasping, and retrieving task for head-fixed mice. Front. Neural Circuit 16, 842748.
- Tsutsumi S et al. (2019) Modular organization of cerebellar climbing fiber inputs during goal-directed behavior. eLife 8, e47021.
- Inoue M et al. (2019) Rational engineering of XCaMPs, a multicolor GECI suite for in vivo imaging of complex brain circuit dynamics. Cell 177, 1346-1360.
研究項目 A02「行動変容を導く皮質-皮質下相互作用」
代表者:田中 康裕(玉川大学・教授)
メンバー
| 代表者 | 田中 康裕(玉川大学・教授) |  |
|---|---|---|
| 研究分担者 | 倉本 恵梨子(鹿児島大学・助教) 森島 美絵子(同志社大学・准教授) |
|
研究内容の概要
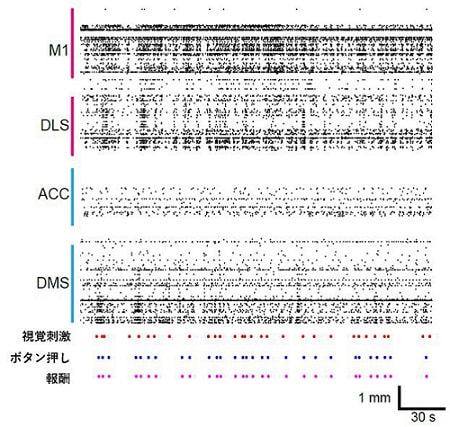
行動変容には意思決定過程が本質的に介在する。意思決定には、様々な外的・内的要因による揺らぎが存在し、このメカニズムを解明することは行動変容を理解あるいは予測、操作するうえで重要である。動物を用いた行動課題上、もっとも単純な意思決定課題の一つとして、感覚刺激を知覚あるいは比較し、報酬を得られる選択肢を選ぶという知覚的意思決定課題がある。実際に動物を訓練すると、その学習過程には課題成功率が不安定な時期がある。このような時期においては、個々の動物の生活歴や訓練歴あるいは個々の動物の試行錯誤などによる神経回路の柔軟な組み換えや使い分けが起きると考えられ、行動変容を理解するうえで有効な動物モデルとなりうる。本研究では、行動変容、特に意思決定学習過程における大脳皮質―大脳基底核―視床並列ループにおける情報動態の変化及びその働きを解明することを目標とする。そのために、意思決定学習課題における行動を解析し、大脳皮質―大脳基底核―視床並列ループの解剖学的検討を行い、学習過程での大脳皮質―大脳基底核―視床並列ループ情報動態を測定する。また、スライス電気生理も用いることでループ内外のシナプス結合についても調べる。
文献
- Tanaka YH et al. (2018) Thalamocortical axonal activity in motor cortex exhibits layer-specific dynamics during motor learning. Neuron 100, 244-258.e12.
- Morishima M et al. (2017) Segregated excitatory–inhibitory recurrent subnetworks in layer 5 of the rat frontal cortex. Cerebral Cortex 27, 5846–57.
- Kuramoto E et al. (2017) Individual mediodorsal thalamic neurons project to multiple areas of the rat prefrontal cortex: A single neuron-tracing study using virus vectors. J Comp Neurol 525, 166–85.
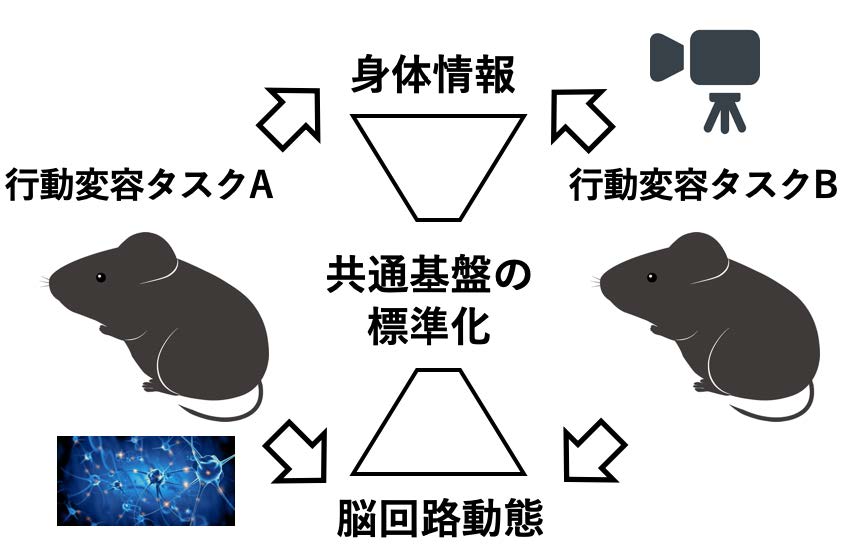
研究項目A02 「脳回路動態に基づく行動変容の標準化」
代表者:中江 健(福井大学・准教授)
メンバー
| 代表者 | 中江 健(福井大学・准教授) |  |
|---|---|---|
| 研究分担者 | 東 広志(京都大学・助教) 篠本 滋(ATR脳情報通信総合研究所・研究員) |
|
| 研究協力者 | Lee Sehyung(京都大学・特定助教) | |
研究内容の概要
本領域で扱われる行動変容は、運動、認知、記憶そして社会性にいたるまで多岐にわたるが、そこでの最重要課題の一つは、行動変容に関わる脳機能単位の抽出と、その機能単位に基づく行動変容の定量化である。近年の画像処理技術の発展により、カメラ画像から身体特徴を網羅的に取得することができるようになった。本研究では、行動変容に関わる複数のタスク(ヒトおよびマウスを対象に総括班にてデータ取得される)において、個体内あるいは個体間で共通する身体情報と、それを駆動する脳回路動態(機能的結合)の抽出および標準化を行う。近年のAIベースの画像処理技術の大幅な進展を利用する。標準化された身体情報と脳回路動態に基づき、それらの関係性(潜在空間での座標)の変化として行動変容を定量評価し、もって心的状態が駆動する脳-身体機能連関である行動変容の基盤を明らかにする。
文献
- Okochi Y, Sakaguchi S, Nakae K, Naoki H. (2021) Model-based prediction of spatial gene expression via generative linear mapping. Nature Communications 12, 3731, 2021.
- Kobayashi R et al. (2019) Reconstructing neuronal circuitry from parallel spike trains. Nature Communications 10, 4468.
- Ito R, Nakae K et al. (2019) Semi-supervised deep learning of brain tissue segmentation, Neural Netw 116, 25-34.
公募研究班
「公募班員 2025-2026年度」
研究項目A01「小脳が左右する社会性行動の調整原理の解明」
代表者:松井 広(東北大学・教授)
メンバー
| 代表者 | 松井 広(東北大学・教授) |  |
|---|
ウェブサイト
http://www.ims.med.tohoku.ac.jp/matsui/
研究内容の概要
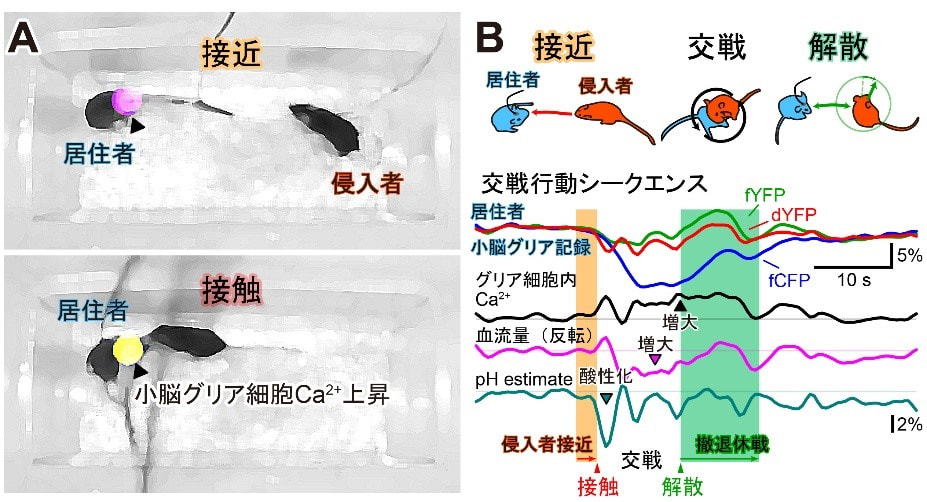
人類は社会的な生物であり、個人の脳は社会や環境の影響を受けて、情報処理や動作モードを柔軟に変化させる。新型コロナ禍では、各国で社会的距離(social distance)が取られたが、現在、その継続が脳に与えた影響を検証する好機とも言える。本研究では、離乳後に集団飼育または隔離飼育されたマウス、さらに新たな集団環境へ移されたマウスの行動と小脳活動を解析する。小脳に注目するのは、近年その社会性を調節する機能が指摘されているためである。当研究室では、雄マウス同士の攻撃行動時に、小脳の局所フィールド電位に5–10 Hzのシータ波が現れることを明らかにしている。そこで本研究では、光ファイバーにタングステン電極を沿わせた自作のオプトロードを小脳虫部に留置し、1)神経細胞由来の集合的電気活動、2)バーグマングリア細胞内のpH、Ca2+、代謝産物の変動、3)局所脳血流量の変化を同時計測する。さらに、マウスの多様な行動に関するビデオデータも加え、多次元データの解析を通じて、行動変容の原理解明を目指す。
文献
- Yamao H, Matsui K. (2025) Astrocytic determinant of the fate of long-term memory. Glia 73, 309-329.
- Asano Y, Sasaki D, Ikoma Y, Matsui K. (2024) Glial tone of aggression. Neuroscience Research 202, 39-51.
- Ikoma Y, Sasaki D, Matsui K. (2023) Local brain environment changes associated with epileptogenesis. Brain 146, 576-586.
- Morizawa YM, ..., Matsui K. (2022) Synaptic pruning through glial synapse engulfment upon motor learning. Nature Neuroscience 25, 1458-1469.
研究項目A01「痛覚応答を変容させる島皮質ー視床連関メカニズム」
代表者:宮田 麻理子(東京女子医科大学・教授、基幹分野長)
メンバー
| 代表者 | 宮田 麻理子(東京女子医科大学・教授、基幹分野長) |  |
|---|---|---|
| 研究協力者 | 児玉 貴史(東京女子医科大学・講師) 加世堂 竜太郎(東京女子医科大学・助教) 佐藤 由宇(東京女子医科大学・ポスドク) |
|
ウェブサイト
https://www.twmu.ac.jp/neurophysiology/
研究内容の概要
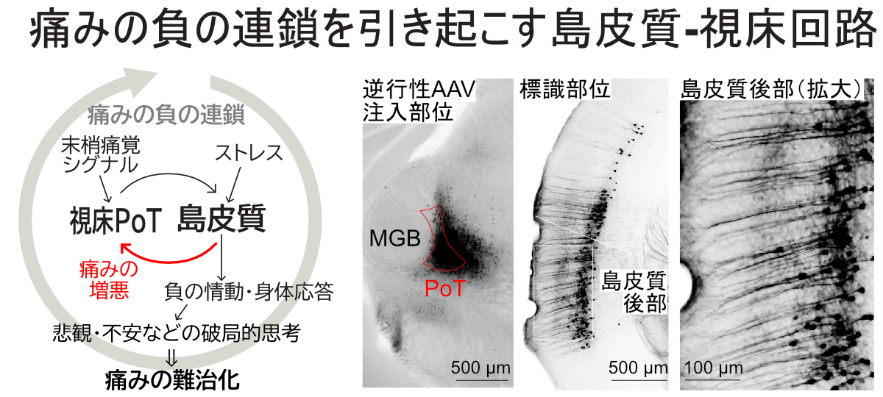
中枢性疼痛と言われる視床痛や幻肢痛などは、末梢の侵害刺激がなくとも主観的「痛み」を感じることから、「痛覚」は中枢神経で生み出されていると言っても過言でない。慢性疼痛患者では、痛みがストレスを生み、ストレスは主観的「痛み」を増幅させるという負の連鎖が不安・苦痛・悲観などの破局的思考を生み出し、痛みを難治化させることが臨床的問題となっている。島皮質は痛覚受容とストレス応答の中枢であることから、この負の連鎖の神経基盤である可能性が高い。申請者らは、マウスにおいて、末梢からの痛覚伝導路の終止点である痛覚視床核(PoT)がその投射先である島皮質後部から強いトップダウン入力を受けることを見出した。このことは、島皮質で統合された痛覚・ストレス情報が痛覚視床核PoTとループを作って、「痛み」を過剰に増幅させたり、あるいは末梢からの侵害シグナルがなくても「痛覚」を発動させる可能性を示す。そこで、本研究では島皮質-PoTループに着目し、高精度・低侵襲な光遺伝学的侵害刺激と自律神経応答等を組み合わせた痛覚身体応答指標の確立を目指し、島皮質―PoTループの神経活動と痛覚身体応答をリアルタイムで評価・操作することで、主観的な「痛覚」における役割を明らかにする。
文献
- Osaki H et al. (2022) Distinct nociception processing in the dysgranular and barrel regions of the mouse somatosensory cortex. Nat Commun 13, 3622.
- Nagumo Y et al. (2020) Tonic GABAergic Inhibition Is Essential for Nerve Injury-Induced Afferent Remodeling in the Somatosensory Thalamus and Ectopic Sensations. Cell Reports 31, 107797.
- Takeuchi Y et al. (2014) Large-Scale Somatotopic Refinement via Functional Synapse Elimination in the Sensory Thalamus of Developing Mice. J. Neurosci. 34, 1258–1270.
- Miyata M et al. (2003) Role of Thalamic Phospholipase Cβ4 Mediated by Metabotropic Glutamate Receptor Type 1 in Inflammatory Pain. J. Neurosci. 23, 8098–8108.
研究項目A01「脳状態操作が紐解く集中力の基本原理」
代表者:堀 祐樹(量子科学技術研究開発機構・研究員)
メンバー
| 代表者 | 堀 祐樹(量子科学技術研究開発機構・研究員) |  |
|---|
ウェブサイト
https://www.qst.go.jp/site/iqms/1869.html
研究内容の概要
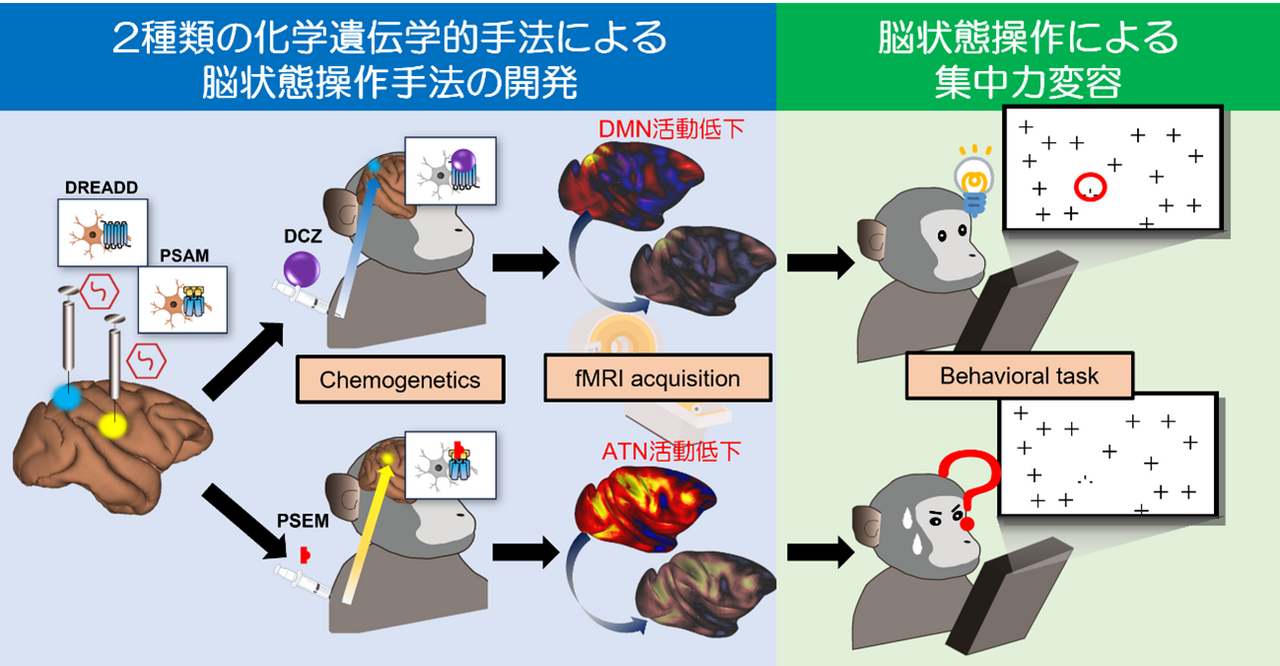
「集中力」は、自己のパフォーマンスを最大限に発揮するために必要な高次脳機能である。その障害は持続性注意障害として複数の精神疾患において顕在化するが、集中力を生み出す脳の基本原理は未だ不明であり、高集中力状態を生み出す手法の開発が必要である。本研究では、将来的な注意機能障害の病態理解、治療を意識したうえで、集中力を生み出す脳の基本原理の理解を目指す。そのために、集中力を従来の単一ネットワークによる制御ではなく、複数のネットワークの動的活動バランスによって特徴づけられる新たな脳状態制御モデルとして捉え、高い集中力状態を作り出すメカニズムを解明する。複数の脳回路を化学遺伝学的に操作し、一過性に誘導される脳状態ダイナミクスの変容がどのように集中力へ影響するかを検証することで、集中力を制御する脳回路を理解する。その成果から集中力を生み出す手法の基礎技術を確立し、注意力の低下が見られる精神疾患の診断・治療支援に結び付く波及効果が期待される。
文献
- Yuki Hori et al., (2025) Remote cortical network for frontal cognitive symptoms derived from tau accumulation in progressive supranuclear palsy. BioRxiv.
- Yuki Hori et al., (2023) Multimodal imaging for validation and optimization of ion channel-based chemogenetics in nonhuman primates. J Neurosci. 43, 6619-6627.
- Yuki Hori et al., (2022) Functional organization of frontoparietal cortex in the marmoset investigated with awake resting-state fMRI. Cereb Cortex 32, 1965-1977.
- Yuki Hori et al., (2021) Interspecies activation correlation reveal functional correspondences between marmoset and human brain areas. Proc Natl Acad Sci USA 118, e2110980118.
研究項目A01「運動異常症における行動変容と回路操作による治療」
代表者:南部 篤(生理学研究所・特別協力研究員)
メンバー
| 代表者 | 南部 篤(生理学研究所・特別協力研究員) |  |
|---|---|---|
| 研究協力者 | 小林 憲太(生理学研究所•准教授) | |
ウェブサイト
研究内容の概要
これまでサル、マウスを用いて、パーキンソン病、ジストニア、ジスキネジアなどの運動異常症の病態メカニズムや治療法について研究を行ってきました。これらの運動異常症において、大脳基底核の神経活動、とくに大脳基底核の出力核における大脳皮質由来の神経活動が、系統的に変化することがわかりました。また治療を施すと、出力核の神経活動が正常化するとともに、症状が改善しました。すなわち、症状発現という行動変容と神経活動•神経ネットワークの変化が相関し、神経活動•神経ネットワークの異常が症状を引き起こし、逆に操作•介入することにより正常化すれば治療につながることになります。本研究では、サルを中心に運動異常症モデルを作製し、症状の基盤にある神経活動•神経ネットワークの異常を特定するとともに、神経ネットワークに操作を加えることにより神経活動を正常化させ、症状を改善することを目指します。これは運動異常症などの神経疾患ばかりでなく、うつや統合失調症などの精神疾患の治療法にもつながる可能性があります。
また、サルばかりでなくマウス、ラットからの神経活動記録(ユニット記録、脳波記録など)も得意としているので、班員の方に協力できればと思います。
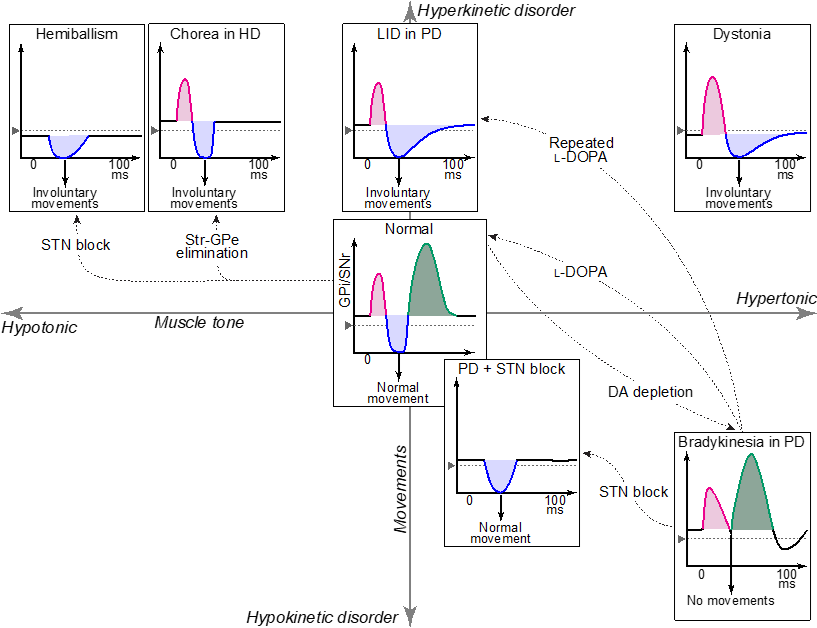
大脳基底核出力核における大脳皮質由来の反応パターンは、様々な運動異常症モデルにおいて系統的に変化する。
文献
- Polyakova Z, Hatanaka N, Chiken S, Nambu A. (2024) Subthalamic activity for motor execution and cancelation in monkeys. J Neurosci 44, e1911222024.
- Nambu A, Chiken S, Sano H, Hatanaka N, Obeso JA. (2023) Dynamic activity model of movement disorders: The fundamental role of the hyperdirect pathway. Mov Disord 38, 2145-2150.
- Hasegawa T, Chiken S, Kobayashi K, Nambu A. (2022) Subthalamic nucleus stabilizes movements by reducing neural spike variability in monkey basal ganglia. Nat Commun 13, 2233.
研究項目A01「潜在意識下で意思決定を実行する脳動態の計測と操作」
代表者:松本 正幸(京都大学・教授)
メンバー
| 代表者 | 松本 正幸(京都大学・教授) |  |
|---|
ウェブサイト
https://www.pri.kyoto-u.ac.jp/sections/systems_neuroscience/
研究内容の概要
我々は外界の情報を知覚し、その情報を基に適切な行動を選択する。一方、ヒトを対象にした先行研究は、知覚に上らない潜在意識下の情報が意思決定に影響することを報告している。ただ、侵襲的な手法を用いた動物実験は見られず、潜在意識下の情報が意思決定に反映される神経メカニズムは不明である。その中で、我々の研究グループでは、マカクザルを対象にした電気生理実験により、中脳ドーパミンニューロンや偏桃体の神経活動が知覚に上らない潜在意識下の情報をコードすることを見出した。本研究では、これらの神経活動が意思決定に果たす役割を解析するため、マカクザルに知覚することが難しい条件で視覚刺激を提示し、この刺激の情報を基に選択肢の中から一つを選ばせる意思決定課題を考案した。課題遂行中のサルを対象にして、ドーパミンニューロンや偏桃体を含む意思決定神経回路の神経活動を計測・操作し、同時に意思決定に付随する情動や動機づけを反映する生理・行動指標を測定する。本研究の成果は、潜在意識下で行われる意思決定の生物学的基盤を明らかにするとともに、潜在意識に関わる多次元の脳動態データ・行動データを提供することによって当該学術変革領域の推進に貢献する。
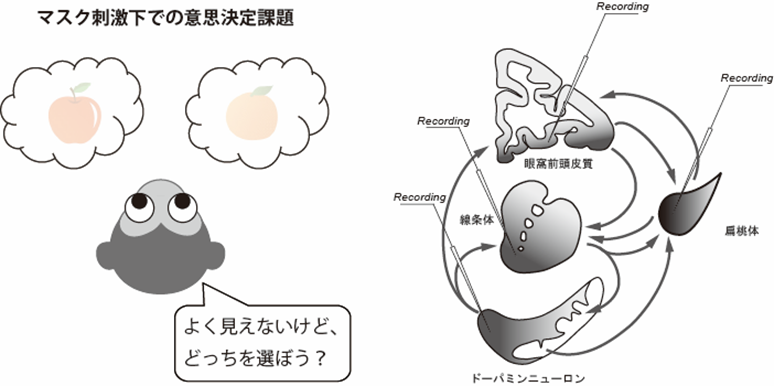
文献
- Yun M, Nejime M, Kawai T, Kunimatsu J, Yamada H, Kim HGR, Matsumoto M. (2023) Distinct roles of the orbitofrontal cortex, ventral striatum, and dopamine neurons in counterfactual thinking of decision outcomes. Science Advances 9, eadh2831.
- Wang Y, Toyoshima O, Kunimatsu J, Yamada H, Matsumoto M. (2021) Tonic firing mode of midbrain dopamine neurons continuously tracks reward values changing moment-by-moment. Elife 10, e63166.
- Yun M, Kawai T, Nejime M, Yamada H, Matsumoto M. (2020) Signal dynamics of midbrain dopamine neurons during economic decision-making in monkeys. Science Advances 6, eaba4962.
- Ogasawara T, Nejime M, Takada M, Matsumoto M. (2018) Primate nigrostriatal dopamine system regulates saccadic response inhibition. Neuron 100, 1513-26.
研究項目A01:行動変容の創発における前障−大脳皮質広域ネットワークの動態解明
代表者:吉原 良浩(理化学研究所・チームリーダー)
メンバー
| 代表者 | 吉原 良浩(理化学研究所・チームリーダー) |  |
|---|---|---|
| 研究協力者 | 日野 喬央(理化学研究所・特別研究員) 新井 亜紀(理化学研究所・テクニカルスタッフ) 卜部 美帆(理化学研究所・テクニカルスタッフ) 吉田 崇将(帝京大学・助教) |
|
ウェブサイト
https://cbs.riken.jp/jp/faculty/y.yoshihara/
研究内容の概要
安静状態におけるDefault Mode Network、顕著性を抽出するSalience Network、運動発現などの実行機能を生み出すCentral Executive Networkなど、大脳皮質には機能的に連関した領野間を結びつける複数の広域ネットワークが存在する。行動変容を創発する脳ダイナミクスの神経基盤として、感覚入力からのボトムアップ指令および内的状態のトップダウン指令に基づきこれらの広域ネットワークが迅速かつ正確に切り替わることが重要であると考えられるが、その動作メカニズムは未解明である。前障(Claustrum)は島皮質の内側に存在する薄いシート状の構造であり、すべての皮質領野と双方向性に神経結合するユニークな脳領域である。私たちは前障特異的にDNA組換え酵素Creを発現するトランスジェニックマウス系統を樹立し、前障が大脳皮質の広範な領域において神経活動のDown Stateを同期的に引き起こし、徐波活動を制御することを発見した。また最近、前障の背側部ニューロンは感覚・運動野に、腹側部ニューロンは連合野に選択的に出力していることを見出し、大脳皮質広域ネットワークの調節への前障の関与が示唆された。そこで本研究では「前障が大脳皮質広域ネットワークのスイッチボードとして機能することにより行動変容が創発される」という仮説を立て、行動学・光/化学遺伝学・生理学・解剖学など多様な実験手法を統合的に組み合わせ、行動変容の創発における前障の機能の解明に挑戦する。
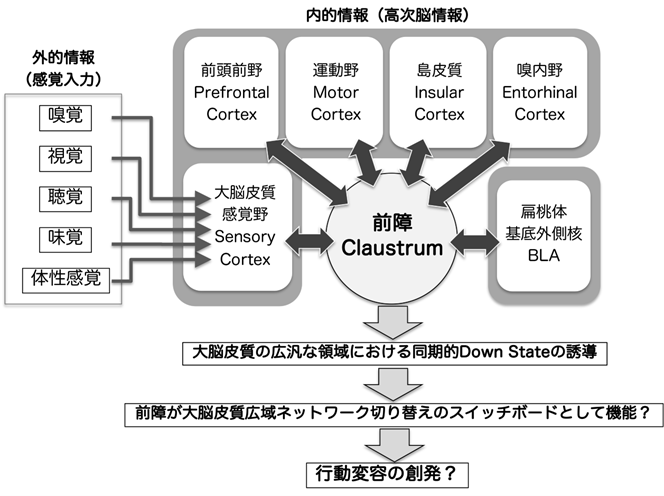
文献
- Masuda M et al. (2024) Identification of olfactory alarm substances in zebrafish. Current Biology 34, 1377-1389.
- Hiraki-Kajiyama T. et al. (2024) An atlas and database of neuropeptide gene expression in the adult zebrafish forebrain. Journal of Comparative Neurology 532: e25619.
- Narikiyo K. et al. (2020) The claustrum coordinates cortical slow-wave activity. Nature Neuroscience 23, 741-753.
研究項目A01「パーキンソン病症状改善の脳内メカニズム」
代表者:知見 聡美(生理学研究所・助教)
メンバー
| 代表者 | 知見 聡美(生理学研究所・助教) |  |
|---|
研究内容の概要
多くのパーキンソン病患者さんの症状改善に貢献している脳深部刺激療法(DBS)が、刺激部位を含めた全脳に対してどのような活動変化をもたらし、運動症状を改善させるのかという問題を解明することは、効果的な治療法の開発につながるだけでなく、システムとしての脳機能の理解にも大きく役立ちます。私たちはこれまでDBSの作用メカニズムについて研究を行ってきましたが、電気刺激は刺激部位の神経細胞を刺激するだけでなく、刺激部位に投射する神経軸索の終末から神経伝達物質を放出させたり、刺激部位に投射する軸索を逆行性に興奮させ、その投射先にも影響を及ぼすため、症状改善に寄与する神経経路の特定が困難でした。また、刺激部位と直接の投射先への作用を電気生理学的に調べることは可能でしたが、脳全体の変化については着手できませんでした。しかし、最近発展してきた光遺伝学や化学遺伝学の手法を用いれば、特定の神経経路のみを賦活/抑制できるため、症状改善に寄与する神経経路を特定できます。また、光遺伝学によるDBSを施した際に機能的 MRI 計測を行えば、全脳における変化の可視化も可能です。本研究では、DBS が運動症状を改善させる治療メカニズムを明らかにするため、これらの技術をヒトに近い症状を示すパーキンソン病モデルサルに適用し、症状改善に寄与する神経経路を特定するとともに、脳内で生じるどのような変化が症状改善の鍵なのかを明らかにすることを目指します。
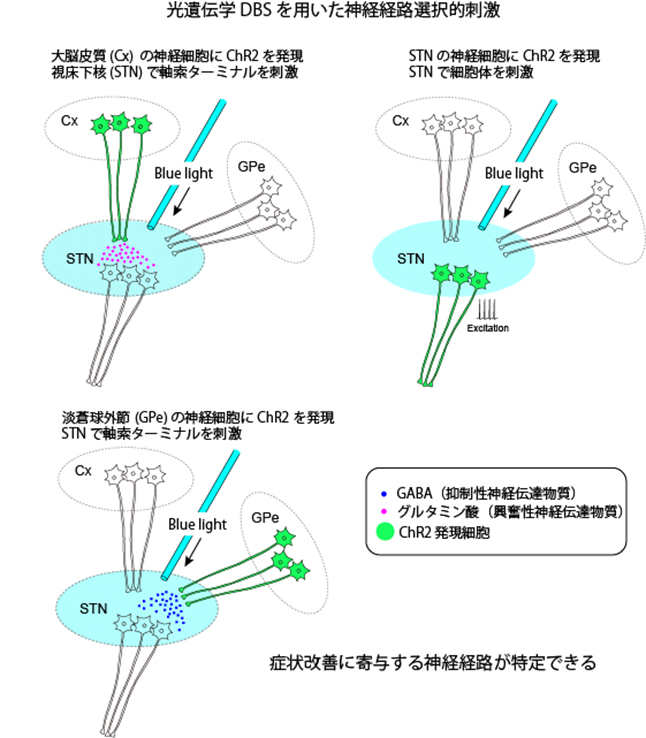
文献
- Hasegawa T, Chiken S, Kobayashi K, Nambu A. (2022) Subthalamic nucleus stabilizes movements by reducing neural spike variability in monkey basal ganglia. Nat Commun 13, 2233.
- Goda N, Hasegawa T, Koketsu D, Chiken S, Kikuta S, Sano H, Kobayashi K, Nambu A, Sadato N, Fukunaga M. (2022) Cerebro-cerebellar interactions in non-human primates examined by optocenetic functional magnetic resonance imaging. Cereb Cortex Commun3, tgac 022.
- Chiken S, Takada M, Nambu A. (2021) Altered dynamic information flow through the cortico-basal ganglia pathways mediates Parkinson's disease symptoms. Cereb Cortex 31, 5363-5380.
研究項目A01「目標指向行動と習慣行動を統合する神経機構の研究」
代表者:鮫島 和行(玉川大学・教授)
メンバー
| 代表者 | 鮫島 和行(玉川大学・教授) |  |
|---|
ウェブサイト
https://www.tamagawa.ac.jp/teachers/samejima/
研究内容の概要
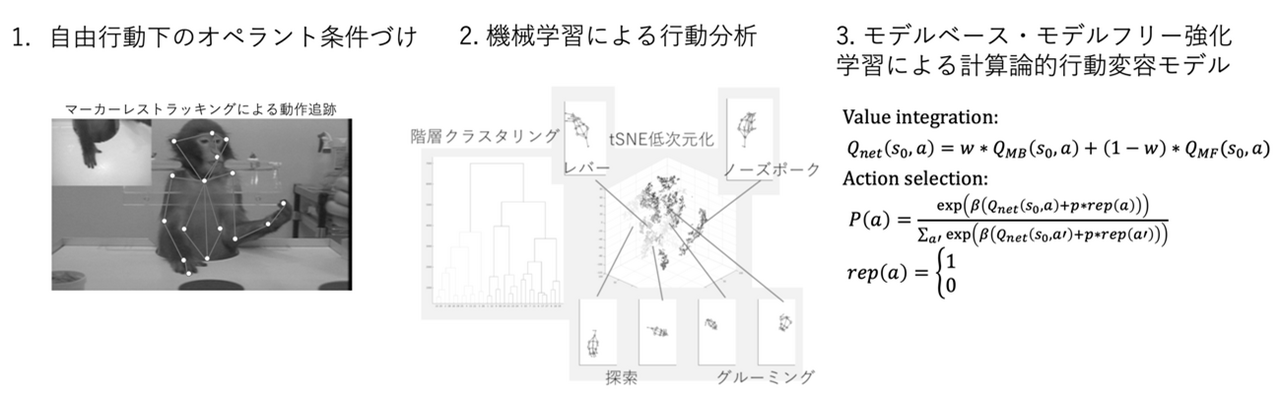
本研究では、オペラント学習の進行に伴って、強化される行動が目的指向行動と習慣行動の間で揺れ動く行動変容を題材に、動物の行動発現メカニズムを心理・神経の両面から探る。これまで、習慣行動は繰り返し同じ行動が同じ様に強化されることで発現し、目的指向行動は次第になくなると考えられてきた。しかし、その様相は複雑であり、環境構造(状態遷移や報酬関数)の変化や、その変動の速さなどの条件に応じて変容する。この現象を、霊長類を用いた行動・神経生理実験によって、特にその行動と神経対応を自由行動下で定量的に観測・分析する。行動変容の構造を機械学習によって記述するのみならず、その現象を計算論的に解釈し、それを実現するアルゴリズムの側面から大脳皮質・大脳基底核を含む神経回路の計算過程をモデリングする。さらに、学習中の神経表現変容と行動変容との神経相関を求めるアプローチによって神経メカニズムの解明を目指す。
文献
- Nonomura S, Samejima K. (2019) Neuronal representation of object choice in the striatum of the monkey. Frontiers in Neuroscience 13, 1283.
- Li G, Hashimoto T, Konno T, Okuda J, Samejima K, Fujiwara M, Morita J. (2019) The mirroring of symbols: An EEG study on the role of mirroring in the formation of symbolic communication systems. Letters on Evolutionary Behavioral Science 10, 7-10.
- Nonomura S, Nishizawa K, Sakai Y, Kawaguchi Y, Kato S, Uchigashima M, Watanabe M, Yamanaka K, Enomoto K, Chiken S, Sano H, Soma S, Yoshida J, Samejima K, Ogawa M, Kobayashi K, Nambu A, Isomura Y, Kimura M. (2018) Monitoring and updating of action selection for goal-directed behavior through the striatal direct and indirect pathways. Neuron 99, 1302-1314.
研究項目A01「脳バリアシステムを介した行動変容機構の解明」
代表者:竹内 秀明(東北大学・教授)
メンバー
| 代表者 | 竹内 秀明(東北大学・教授) |  |
|---|---|---|
| 研究協力者 | 廣井 誠(沖縄科学技術大学院大学・Staff Scientist) 梶山 十和子(東北大学・助教) 鄒 景宜(スウ ケイギ)(東北大学・大学院生) 加賀 ひかり(東北大学・大学院生) |
|
ウェブサイト
https://sites.google.com/view/molecular-ethology-laboratory/
研究内容の概要
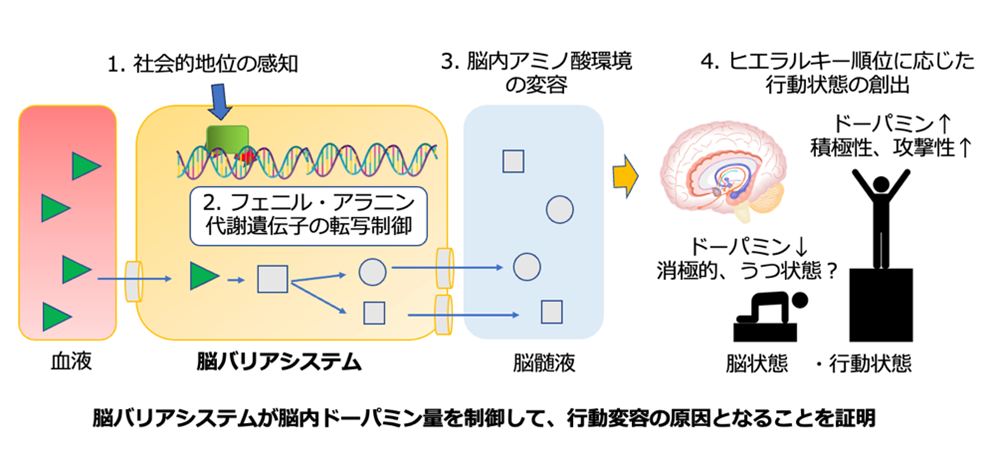
本研究は、脳のバリアシステムが単なる「物理的フィルター」ではなく、社会的地位に応じた行動変容を引き起こす「能動的な調節機構」として機能することを明らかにすることを目的としています。研究代表者らはメダカ集団を用いた実験から、ヒエラルキー形成の過程で劣位個体の脳バリアシステム(髄膜・脈絡叢)において、アミノ酸代謝酵素遺伝子hpdbの発現が特異的に誘導されることを見出しました。hpdbはフェニルアラニン・チロシン代謝に関与する酵素HPDをコードし、ドーパミン前駆体の代謝に関与します。hpdbを欠損させたメダカでは脳内のチロシンおよびドーパミン濃度が増加することから、hpdbの転写変化がドーパミン代謝を介して動機付けや攻撃行動の変化に寄与する可能性があります。本研究では、脳バリアシステムにおけるhpdbの転写調節が、社会的地位依存的な行動状態の形成メカニズムの一端を担うことを検証するとともに、脳全体を包み込む構造を持つ脳バリアシステムが行動制御に果たす新たな役割を提案します。
文献
- Ansai S et al. (2024) The Medaka approach to evolutionary social neuroscience. Neurosci. Res. doi.org/10.1016/j.neures.2024.10.005
- Ueda R et al. (2024) Rapid body colouration changes in Oryzias celebensis as a social signal influenced by environmental background. Biol. Lett20, 20240159.
- Isoe Y et al. (2023) Epigenetically distinct synaptic architecture in clonal compartments in the teleostean dorsal pallium. eLife 12, e85093.
- Yokoi S et al. (2020) Sexually dimorphic role of oxytocin in medaka mate choice. Proc. Natl. Acad. Sci. USA 117, 4802-4808.
研究項目A01「思春期における向社会行動の変容を創発する生物学的基盤の解明」
代表者:松田 哲也(玉川大学・教授)
メンバー
| 代表者 | 松田 哲也(玉川大学・教授) |  |
|---|---|---|
| 研究協力者 | 高岸 治人(玉川大学・教授) 石原 暢(神戸大学・准教授) 田中 大貴(玉川大学・特任助教) 前田 友吾(玉川大学・研究員) |
|
ウェブサイト
https://www.tamagawa.ac.jp/teachers/matspsyc/
研究内容の概要
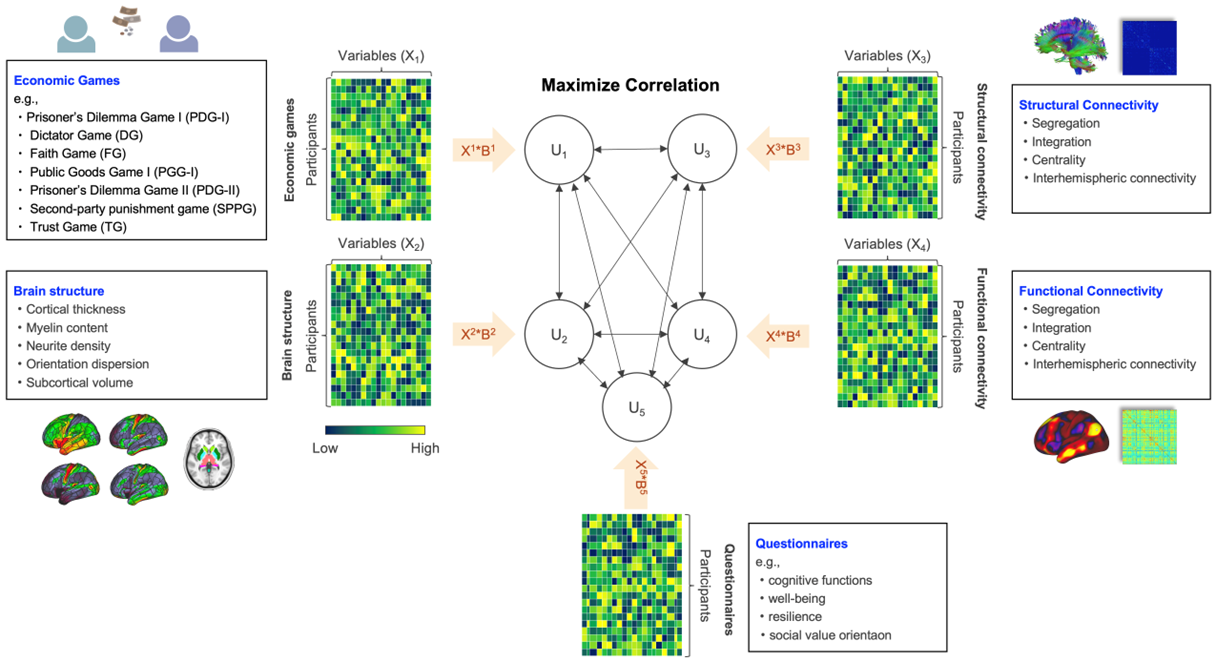
思春期は生物学的な成熟と社会的なアイデンティティーの形成に重要な時期である。思春期の向社会行動の特徴は、成人期以降の社会性についても大きく影響するという意味では、非常に重要であるにも関わらず、これまで思春期の向社会行動の特徴について詳しく調べられた研究はあまり存在していない。そこで本研究では思春期における向社会行動の特徴を明らかにし、社会環境の変化に柔軟に適応することを可能とする向社会行動の変容を創発する生物学的基盤を明らかにすることを目的とする。そのために、我々がこれまでに構築している一般社会人サンプルのデータと現在データを収集している思春期被験者プールのデータを活用し、行動実験(経済ゲーム等)による向社会行動、マルチモーダルMRIによる脳の構造的・機能的基盤、向社会行動と関連があるとされている質問紙指標との関連性を統合的に解析し、発達に伴う向社会行動とそれに関連する心理背景ならびに脳構造・機能の変容を明らかにする。
文献
- Ishihara T, Tanaka H, Kiyonari T, Matsuda T, Takagishi H.(2025) Multimodal imaging to identify brain markers of human prosocial behavior. eNeuro 12(3), 0304-24.
- Ishihara T, Miyazaki A, Tanaka H, Fujii T, Takahashi M, Nishina K, Kanari K, Takagishi H, Matsuda T. (2021) Childhood exercise predicts response inhibition in later life via changes in brain connectivity and structure. Neuroimage 237, 118196.
- Ishihara T, Miyazaki A, Tanaka H, Matsuda T. (2020) Identification of the brain networks that contribute to the interaction between physical function and working memory: An fMRI investigation with over 1,000 healthy adults. Neuroimage 221, 117152.
研究課題名A02「柔軟な行動変容に必要な情報選択の神経メカニズムの解明」
代表者:宇賀 貴紀(山梨大学・教授)
メンバー
| 代表者 | 宇賀 貴紀(山梨大学・教授) |  |
|---|---|---|
| 研究協力者 | 熊野 弘紀(山梨大学・助教) 須田 悠紀(山梨大学・助教) |
|
ウェブサイト
https://www.med.yamanashi.ac.jp/basic/integphys/
研究内容の概要
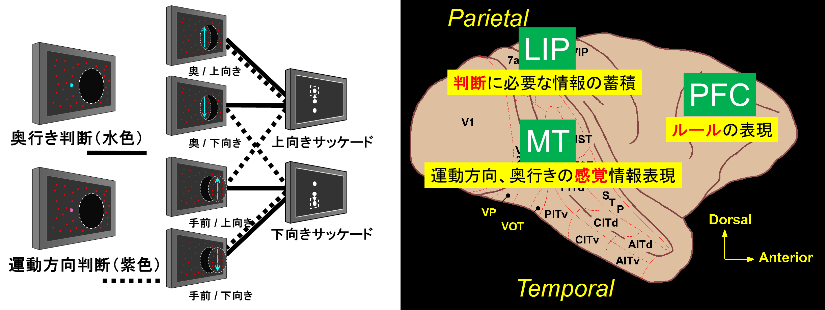
環境に応じて柔軟に判断を切り替えるタスクスイッチングは、ヒトを含めた霊長類特有の適応的な認知機能である。我々はこれまで、2つの環境(ルール)に応じて柔軟に判断を切り替えるタスクスイッチ課題を世界ではじめてサルに適用し(Sasaki & Uka, Neuron, 2009)、柔軟な行動変容の神経メカニズムを解明してきた(Kumano, Suda & Uka, J Neurosci, 2016; Sasaki et al., Cereb Cortex, 2022; Suda & Uka, Commun Biol, 2022; Kumano & Uka, NeuroReport, 2024)。これらの結果から、柔軟な判断に「どの」情報を収集するのかを制御するシステムが大きく関わっていることが明らかになってきた。本研究では、柔軟な行動変容に必須である情報収集と情報選択の制御機構を解明することを目的とする。そのため、情報選択の制御に重要と考えらえる前頭前野の広域脳動態情報を明らかにし、情報収集に特化した感覚-判断の局所脳動態情報との相互作用を明らかにする。
文献
- Kumano H, Uka T. (2024) Employment of time-varying sensory evidence to test the mechanisms underlying flexible decision-making.NeuroReport 35, 107-114.
- Suda Y, Uka T. (2022) The NMDA receptor antagonist ketamine impairs and delays context-dependent decision making in the parietal cortex. Commun Biol 5, 690.
- Sasaki R, Kumano H, Mitani A, Suda Y, Uka T. (2022) Task-specific employment of sensory signals underlies rapid task switching. Cereb Cortex32, 4657-4670.
- Kumano H, Suda Y, Uka T. (2016) Context-dependent accumulation of sensory evidence in the parietal cortex underlies flexible task switching. J Neurosci36, 12192–12202.
研究課題名A02「環境適応的な行動変容を支えるドパミン信号の時空間ダイナミクスの解明」
代表者:水関 健司(大阪公立大学・教授)
メンバー
| 代表者 | 水関 健司(大阪公立大学・教授) |  |
|---|---|---|
| 研究協力者 | 松本 英之(大阪公立大学・助教) 荒巻 知子(大阪公立大学・研究員) |
|
ウェブサイト
https://www.omu.ac.jp/med/neuroscience/
研究内容の概要
環境に応じて柔軟に行動を選択する能力は、ヒトを含めた動物の生存に必須です。中脳に分布するドパミン細胞は広範囲の脳領域へ軸索を投射し、環境に応じた柔軟な行動変容に重要な役割を果たしていると考えられています。しかし、ドパミン細胞がどのような時間パターンの信号をどの脳領域に送ることで多様な機能を制御しているのかは、技術的な困難さのため、よくわかっていません。本研究では、投射先脳領域を同定したドパミン細胞の活動を記録・操作する技術を確立します(図)。これらの技術を、報酬環境に応じて選択行動を柔軟に変化させるラットに適用します。そして、動物が環境に応じて柔軟な選択行動を行う際に、ドパミン細胞がどのような時間パターンの信号をどの脳領域に送ることで、環境適応的な行動変容を支えているのかを解明します。本研究は、環境に応じた柔軟な行動変容の基盤となる、ドパミン細胞を中心とした多領域連関と情報並列処理のメカニズムの解明を目指します。
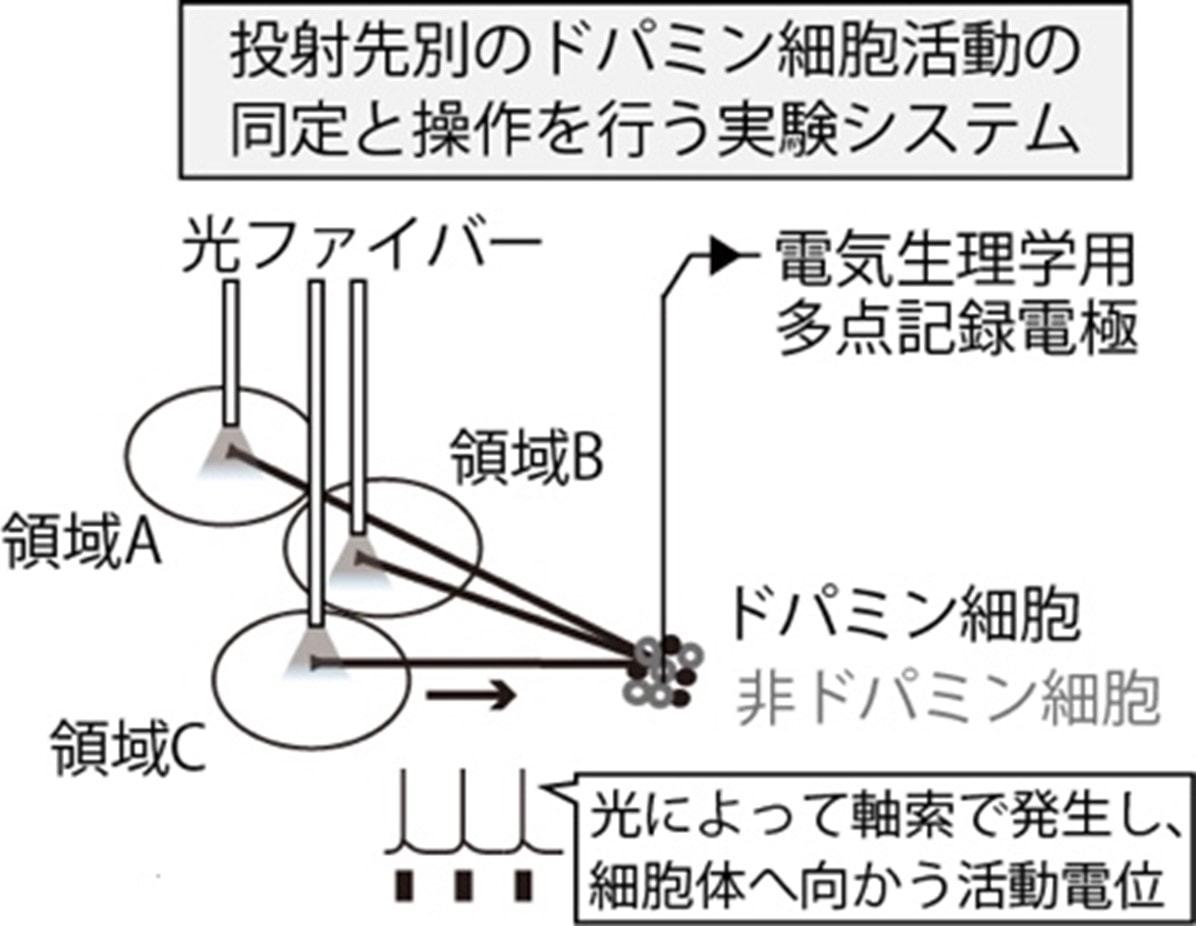
文献
- Nakai S, Kitanishi T, Mizuseki K. (2024) Distinct manifold encoding of navigational information in the subiculum and hippocampus. Science Advances 10, eadi4471.
- Miyawaki H, Mizuseki K. (2022) De novo inter-regional coactivations of preconfigured local ensembles support memory. Nature Communications 13,1272.
- Kitanishi T, Umaba R, Mizuseki K. (2021) Robust information routing by dorsal subiculum neurons. Science Advances 7, eabf1913.
研究課題名A02:「文化伝達による行動変容の神経機構解明」
代表者:牧野 浩史(慶應義塾大学・教授)
メンバー
| 代表者 | 牧野 浩史(慶應義塾大学・教授) |  |
|---|
ウェブサイト
https://www.med.keio.ac.jp/research/faculty/9-164643/
研究内容の概要
生命はさまざまな環境に適応するために、他者からの「教示」や「模倣」を通じて新しい知識や技能を獲得してきた。これらの学習形態によって個体間で共有される行動様式や知識の体系は「文化」と呼ばれ、世代を超えて累積的に進化していく。文化の伝達は集合知における本質的な現象であるにもかかわらず、その神経機構については十分に理解されていない。本研究では、集団内で文化伝達を支える神経機構の解明を目標に、多数のマウスAIエージェントを構築し、エージェント集団内で文化が伝わる様子を仮想空間でシミュレーションする理論的アプローチと、実際のマウスを対象に最先端の神経記録・操作手法を適用する実験的アプローチを融合する。このような仮想社会と実社会の双方向的な比較を通じてマウス集団内で文化がいかに伝達されるのか、そしてそれを担う神経表現やニューロモジュレーターの役割は何かを明らかにすることを目指す。
文献
- Makino H, Suhaimi A. (2025) Distributed representations of temporally accumulated reward prediction errors in the mouse cortex. Science Advances 11, eadi4782.
- Chia XW, Tan JK, Ang LF, Kamigaki T, Makino H. (2023) Emergence of cortical network motifs for short-term memory during learning. Nature Communications 14, 6869.
- Makino H. (2023) Arithmetic value representation for hierarchical behavior composition. Nature Neuroscience 26, 140-149.
- Suhaimi A, Lim AWH, Chia XW, Li C, Makino H. (2022) Representation learning in the artificial and biological neural networks underlying sensorimotor integration. Science Advances 8, eabn0984.
研究課題名A02「精神疾患研究のための超マルチモーダル感情見本の作成」
代表者:林(高木)朗子(理化学研究所・チームリーダー)
メンバー
| 代表者 | 林(高木)朗子(理化学研究所・チームリーダー) |  |
|---|---|---|
| 研究協力者 | 堤 新一郎(理化学研究所・副チームリーダー) 小澤 克也(理化学研究所・テクニカルスタッフ) Tanvil Islam(理化学研究所・テクニカルスタッフ) |
|
ウェブサイト
https://multi-scale_psychiatry.riken.jp/
研究内容の概要
自閉スペクトラム症は強い遺伝素因をもつ症候群であるため、発症寄与の高い遺伝子に立脚した疾患モデル動物の解析が有効です。本研究は、このようなモデルマウスを臨床の着眼点で行動解析し、シナプス入力や神経発火パターンと擦り合わせることで精神疾患の行動変容の生物学的メカニズムの解明を目指します。発症寄与の高い疾患関連遺伝子としてCHD8が知られており、CHD8 hetero KO(hKO)を自閉スペクトラム症(ASD)モデルとして解析します。ASDの主症状は社会的コミュニケーションの障害であり、認知的歪みや感覚過敏に伴う周辺症状も大きな社会的負担になり、これらの神経回路メカニズムは未解明です。そこで、Head-fixのGo/No-Go課題計測系を基軸に、様々な尺度を超マルチモーダルに解析する行動解析系を創出することを目指します。具体的には、まず、様々な刺激を提示した際に生じるValenceを計測し、各刺激の超マルチモーダル感情見本として確立します。CHD8 hKO、SETD1A hKOなどの発達障害関連モデルマウスにおいても同様の感情見本を作成し、疾患モデルマウスの表情・超音波発声、脳内表象(iGluSnFR/ Ca2+イメージング)が野生型とどのように異なるかを定量します。このような超マルチモーダルアプローチにより、様々な現象が絡み合った最終表現型である行動変容を、各要素にブレイクダウンし、その各々の中核を担う神経回路変容を同定し、疾患病態に立脚した治療法のための非臨床エビデンスの蓄積を目指すことが本課題の目指すものです。
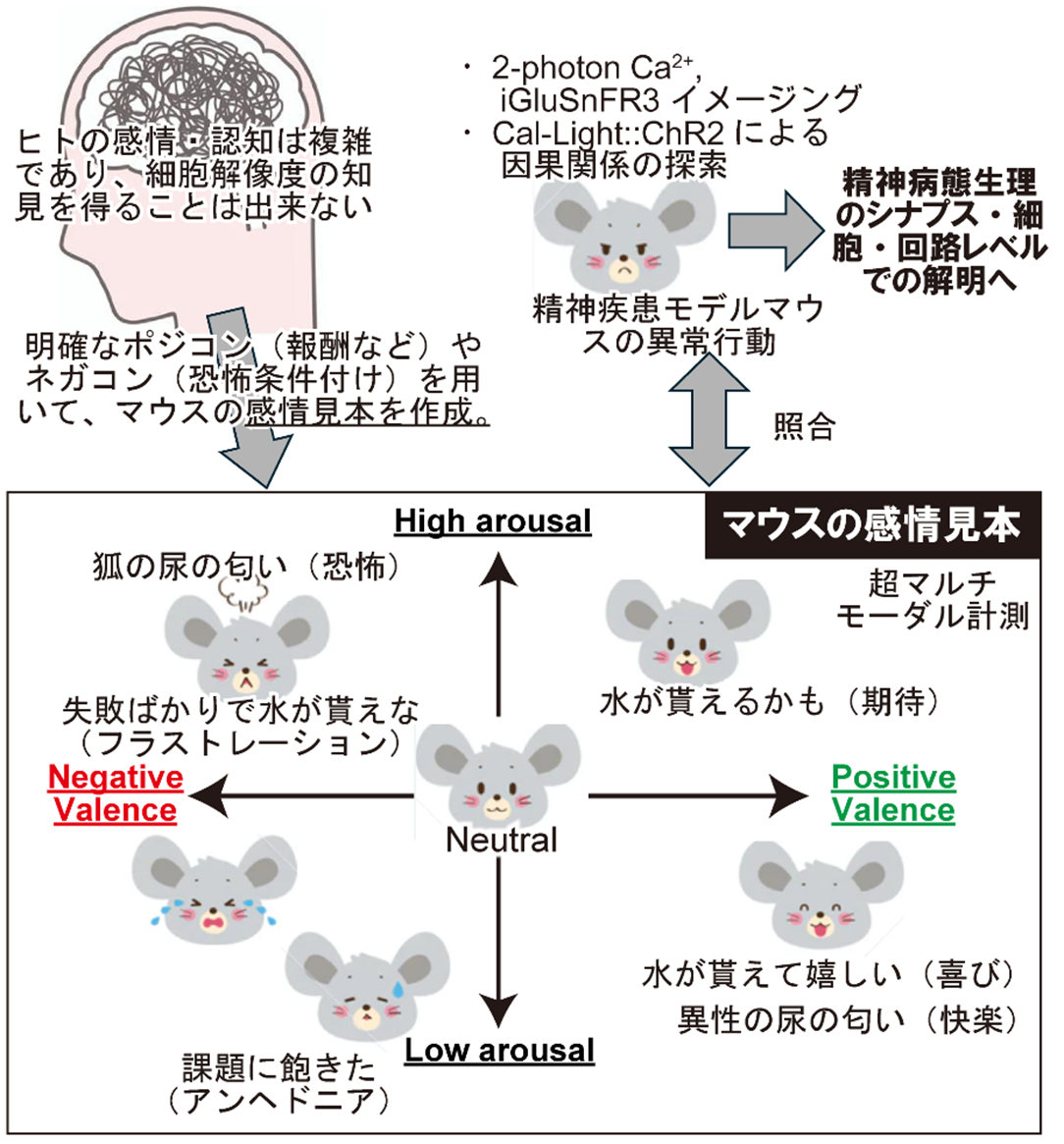
文献
- Obi-Nagata k et al. (2023) Distorted neurocomputation by a small number of extra-large spines in psychiatric disorders. Sci Adv 9 (23), eade5973.
- Tsutsumi S, Hayashi-Takagi A. (2021) Optical interrogation of multi-scale neuronal plasticity underlying behavioral learning. Current Opinion in Neurobiology 67,8-15.
研究課題名A02「マウス視覚野における感覚-運動変換を創発する領野間情報伝播ダイナミクスの解明」
代表者:吉田 盛史(東京大学・講師)
メンバー
| 代表者 | 吉田 盛史(東京大学・講師) |  |
|---|
ウェブサイト
https://researchmap.jp/tks-ysd
研究内容の概要
脳は動物がおかれた状況に応じて感覚情報を適切な行動に変換する。この過程で、適切な情報が適切な脳領野へと伝達される必要があるが、どのような活動パターンや情報が領野間の情報伝播に関与するのかはあまり理解されていない。本研究では、マウス一次視覚野と高次視覚野や連合野を対象として、視覚弁別課題における領野間情報伝播ダイナミクスの解明を目的とする。二光子カルシウムイメージングにより、視覚弁別課題中の視覚野および高次視覚野のニューロン集団の活動を計測し、領野間の相互作用(相関活動)を調べる。マウス視覚野では視覚情報の他に、行動や報酬と関連する神経活動が知られているが、どのような情報を持つ活動が領野間で相関するのか、領野間の相関活動は行動と関連するのかを明らかにする。また、領野間の投射細胞の相関活動への寄与を明らかにする。さらに、学習過程での領野間の相関活動の変化を調べる。これらの研究を通して、行動変容を引き起こす領野間相関活動の解明を目指す。
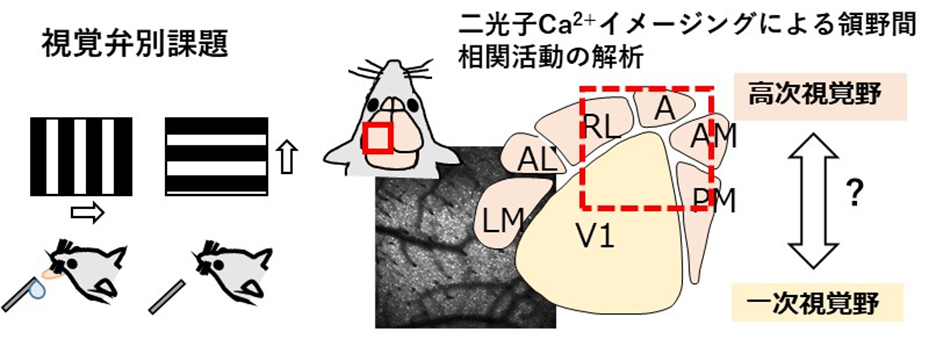
文献
- Yoshida T, Ohki K.(2020) Natural images are reliably represented by sparse and variable populations of neurons in visual cortex. Nature Communications 11,872.
- Ukita J, Yoshida T. Ohki K. (2019) Characterisation of nonlinear receptive fields of visual neurons by convolutional neural network. Scientific reports 9, 3791.
- Aihara S, Yoshida T, Hashimoto T, Ohki K. (2017) Color Representation is retinotopically biased but locally intermingled in mouse V1. Frontiers in neural circuits 11, 22.
研究課題名A02「情動が行動変容に及ぼす影響の解明」
代表者:川端 政則(東京科学大学・助教)
メンバー
| 代表者 | 川端 政則(東京科学大学・助教) |  |
|---|
ウェブサイト
https://www.tmd.ac.jp/med/phy2/
研究内容の概要
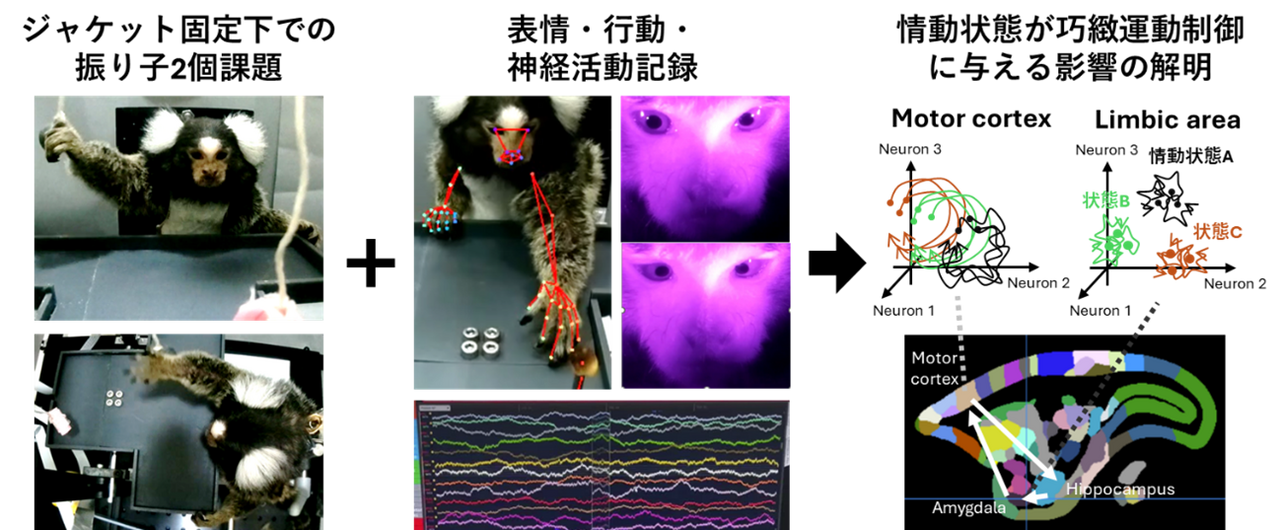
単純作業を行なっている時、同じことを繰り返しているにも関わらず些細な成功や失敗によって喜怒哀楽が生じることがある。こうした情動の変化は、作業の正確さや速度、学習率などに影響を与える。情動は動物が素早く環境適応するために重要なシステムであるが、恐怖以外の情動は実験環境においてシステマチックに再現することが難しいため、神経細胞レベルで情動が行動に与える影響は不明な点が多い。本研究では、振り子を用いて報酬を取る課題(振り子2個課題)を遂行中のジャケット保定下マーモセットから行動・表情・神経活動を同時記録し、表情や行動から推定した情動状態と神経活動から読み出した情動や運動の情報表現の対応関係を調べることで、情動と巧緻運動制御の関連性を明らかにする。情動が神経細胞集団のスパイク活動としてどのように表現されているか、そして運動野をはじめとした局所脳領域の神経活動にどのような影響を与えているかを定量化することで、脳全体としての内部状態と局所神経回路活動の関係を解き明かしたいと考えている。
文献
- Mitani K, Kawabata M, Isomura Y, Sakai Y. (2022) Automated and parallelized spike collision tests to identify spike signal projections. iScience 25(10), 105071-105071.
- Kawabata M, Soma S, Saiki-Ishikawa A, Nonomura S, Yoshida J, Ríos A, Sakai Y, Isomura Y. (2020) A spike analysis method for characterizing neurons based on phase locking and scaling to the interval between two behavioral events. Journal of Neurophysiology 124(6), 1923-1941.
- Saiki A, Sakai Y, Fukabori R, Soma S, Yoshida J, Kawabata M, Yawo H, Kobayashi K, Kimura M, Isomura Y. (2018) In Vivo Spiking Dynamics of Intra- and Extratelencephalic Projection Neurons in Rat Motor Cortex. Cerebral Cortex 28(3),1024-1038.
研究課題名A02「報酬と情動により誘発される顔運動を司る脳神経機構の多次元解析」
代表者:山下 貴之(藤田医科大学・教授)
メンバー
| 代表者 | 山下 貴之(藤田医科大学・教授) |  |
|---|
ウェブサイト
研究内容の概要
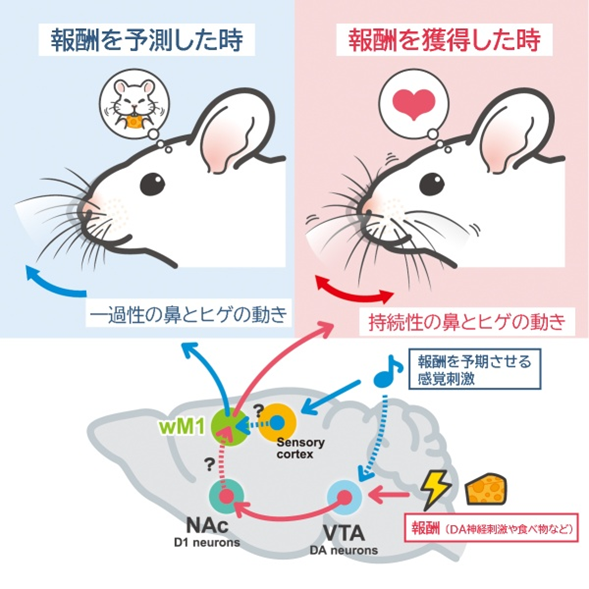
プレゼントが入った袋を開けようとする子供の表情は期待に満ちています。その表情は、プレゼントの内容に満足した時の笑顔とは全く異なることを私たちは知っています。しかしながら、このように動物が状況に応じて見せる多彩な表情がどのような神経機構により形成されるかは十分に解明されていません。私たちは、最近、マウスが報酬を予測した時と報酬を獲得した時に異なる特徴を持つ顔運動を示すことを発見し、これらの報酬関連の顔運動を表象し制御する神経機構の一端を明らかにしてきました(Li et al., Curr. Biol., 2023)。本研究では、多次元的な神経活動計測と行動データとの関連付けにより、報酬と情動によって誘発される顔運動(表情変化)の神経機構をシナプスレベルで明らかにします。さらに、関連脳領域を抑制する実験を通じて、表情変化に関わる領域間での情報の流れの理解を目指します。
(図はイラストレーターのウチダヒロコ氏が作成したイラストを元に山下貴之氏が編集したものです)
文献
- Kawatani et al. (2024) Interareal synaptic inputs underlying whisking-related activity in the primary somatosensory barrel cortex. Journal of Neuroscience 44, e1148232023.
- Li W-R et al. (2023) Neural mechanisms underlying uninstructed orofacial movements during reward-based learning behaviors. Current Biology 33, 3436-3451.
- Matsubara T et al. (2021) Remote control of neural function by X-ray-induced scintillation. Nature Communications 12, 4478.
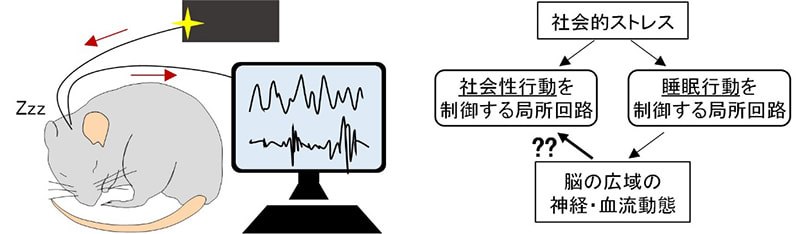
研究課題名A02「多元的行動変容を生み出すストレス-睡眠連関の基盤となる脳動態の解明と操作」
代表者:林 悠(筑波大学・客員教授)
メンバー
| 代表者 | 林 悠(筑波大学・客員教授) |  |
|---|
ウェブサイト
https://hayashi-sleep-lab.net/
研究内容の概要
長期的なストレスは脳や全身に作用し、多様な行動変容を引き起こすが、その現れ方は個体ごとに異なる。ストレス社会と呼ばれる現代において、心身の健康を維持するためには、生物が本来持つレジリエンス(ストレス抵抗性)の神経基盤を理解することが重要である。本研究では、ストレスによる行動変容のうち、特に睡眠と社会性行動に着目する。ストレスがこれらの行動に影響を及ぼすことは広く知られており、その要因として、それぞれの行動を制御する神経回路の変容が考えられる。本研究では、睡眠を制御する神経回路が引き起こす広域的な脳動態の変容が、ストレスによって社会性行動を制御する神経回路の局所動態に影響を与え、結果として社会性の変化をもたらす可能性を検証する。そのメカニズムを明らかにするため、ストレス下における睡眠制御回路やその標的領域への人為的介入の効果を検討する。その際には、これまでに我々が、レム睡眠やノンレム睡眠を制御するニューロンの同定により、個々の睡眠ステージの操作に成功したことを活用する。本研究を通じて、ストレスによる抑うつ状態の形成過程や、それに対する脳の防衛機構について、広域的な脳動態と局所的な脳動態の相互作用に着目し、統合的な理解を目指す。
文献
- Kashiwagi M et al. (2024) A pontine-medullary loop crucial for REM sleep and its deficit in Parkinson’s disease. Cell 187, 6272.
- Kawano T et al. (2023) ER proteostasis regulators cell-non-autonomously control sleep. Cell Reports 42,112267.
- Tsai CJ et al. (2021) Cerebral capillary blood flow upsurge during REM sleep is mediated by A2A receptors. Cell Reports 17,109558.
研究課題名A02「行動変容がもたらす味覚伝導路における情報修飾機構の解明」
代表者:相馬 祥吾(京都府立医科大学・助教)
メンバー
| 代表者 | 相馬 祥吾(京都府立医科大学・助教) |  |
|---|---|---|
| 研究協力者 | 樽野 陽幸(京都府立医科大学・教授) 野村 憲吾(京都府立医科大学・助教) 末松 尚史(京都府立医科大学・助教) 吉田 純一(Yale University School of Medicine・Associate Research Scientist) |
|
ウェブサイト
研究内容の概要
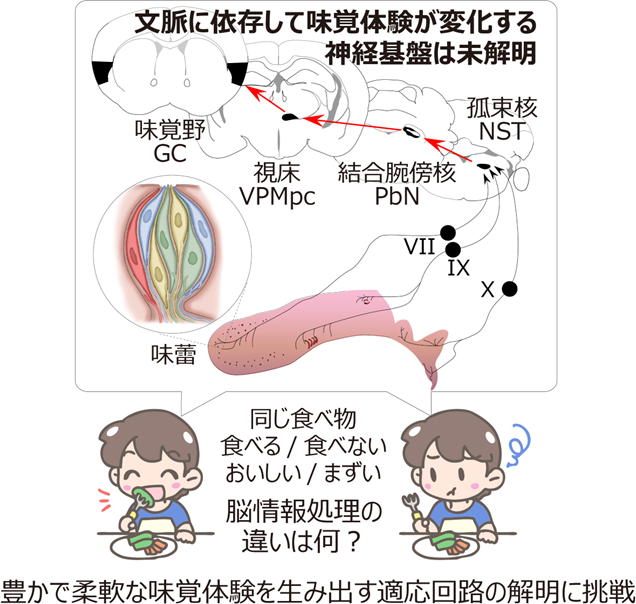
味覚の主な役割は、口に入れる前に食べ物の安全性を判断し、適切な選択へと導くことである。しかし、それだけでなく、食事そのものを楽しみ、心理的な満足感を得るという重要な側面も備える。味覚は私たちの人生に彩りを与える一方で、糖や塩の過剰摂取を招き、健康に悪影響を及ぼすこともある。このように味覚は私たちの生活に深く関わるものであるが、驚くべきことに、甘味・苦味・酸味・塩味・うま味といった基本の味がどのように脳で認識されるのか、その神経メカニズムはまだ解明されていない。本研究では、味を検出する器官である「味蕾」に関する最新の知見(Nomura et al., Neuron 2020)を基に、独自に開発した高精度かつ大規模な計測技術を活用し、味覚がどのように末梢(舌など)から脳へと伝わるのかを明らかにする。さらに、「同じ食べ物でも、その時々で味の感じ方が変わるのはなぜか?」という疑問に対し、生理状態や行動の変化に応じて味覚の情報処理がどのように適応するのか、その根本的な仕組みの解明に挑戦する。
文献
- Soma S☨, Hayatsu N☨, Nomura K☨, Sherwood M☨, Murakami T☨ and Taruno A* et al. (2025) Channel synapse mediates neurotransmission of airway protective chemoreflexes. Cell (in press)
- Suematsu N☨, Sato AY☨, Kimura A, Shimegi S, Soma S☨*. (2025) Perceptual visual acuity declines with age in a rat model of retinitis pigmentosa while light perception is maintained. Invest Ophthalmol Vis Sci 66(3), 31
- Soma S☨*, Ohara S☨, and Isomura Y* et al. (2023) Rat hippocampal CA1 region represents learning-related action and reward events with shorter latency than the lateral entorhinal cortex. Commun Biol 6, 584
- Lee JY☨, Jun H☨, Soma S☨, Nakazono T☨, and Igarashi KM* et al. (2021) Dopamine facilitates associative memory encoding in the entorhinal cortex. Nature 598, 321-326
* Corresponding author, ☨ These authors contributed equally to this work
研究課題名A02「慢性疼痛による行動変容の動作解析と神経機構の解明」
代表者:西丸 広史(富山大学・教授)
メンバー
| 代表者 | 西丸 広史(富山大学・教授) |  |
|---|---|---|
| 研究協力者 | 歌 大介(富山大学・准教授) 小林 亮太(東京大学・准教授) 野本 真順(富山大学・准教授) |
|
ウェブサイト
https://researchmap.jp/nishimaru
研究内容の概要
慢性疼痛は、不安や抑うつなどの気分障害や認知・情動機能障害を合併することが多いことが知られている。これに起因する意欲や注意力が低下し社会生活や就労に支障をきたすことは大きな社会問題になっており、その病態の解明と予防・治療方法の開発が重要な課題である。疼痛の脳内メカニズムの解明は、神経科学分野でも非常に重要なテーマであり、国内外の研究者によって画期的な成果が数多く発表されており注目度も高い。その一方で、高次脳領域における慢性疼痛と合併する精神障害の発症メカニズムについては未だに解明されていないことが多く、現時点で有効な治療法は少ない。最近、脳内で疼痛情報が異常に増幅される「中枢性感作」という現象がこの病態形成に関わっていることが提唱されている。本研究では、申請者らがこれまでに確立した慢性疼痛に起因する動機付け行動変容モデルマウス、情動発現に深く関連した神経回路の活動記録および光遺伝学を用いた操作技術、数理解析および人工知能(AI)を用いた動作・行動解析技術を組み合わせて、意欲や注意力を定量的に測定することができる報酬獲得行動課題遂行中の行動パラメータと神経活動を解析する。これにより行動変容の鍵となる変化を効率的に抽出し、神経回路の機能異常の実態を明らかにする。
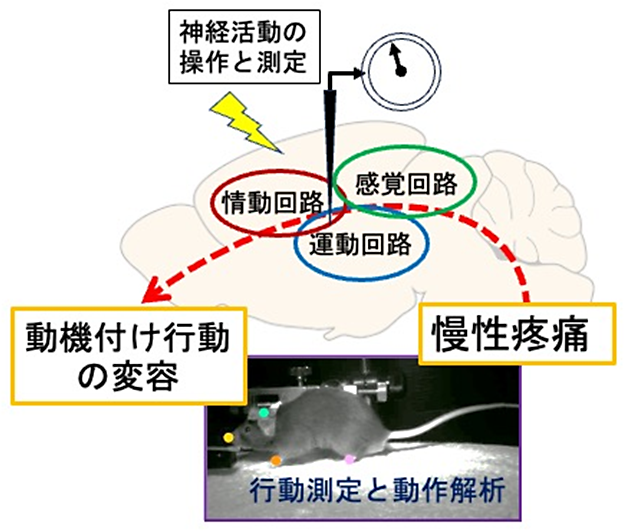
文献
- Sharif A, Matsumoto J, Choijiljav C, Badarch A, Setogawa T, Nishijo H, Nishimaru H. (2024) Characterization of Ultrasonic Vocalization-Modulated Neurons in Rat Motor Cortex Based on Their Activity Modulation and Axonal Projection to the Periaqueductal Gray. eNeuro Volume 11, ENEURO.0452-23.2024.
- Nishimaru H, Matsumoto J, Setogawa T, Nishijo H. (2023)
Neuronal structures controlling locomotor behavior during active and inactive motor states.
Neuroscience Research Volume 189, 83-93. - Sachuriga, Nishimaru H, Takamura Y, Matsumoto J, Mariana Ferreira Pereira de Araújo, Ono T, Nishijo H. (2021)
Neuronal Representation of Locomotion During Motivated Behavior in the Mouse Anterior Cingulate Cortex.
Frontiers in System Neuroscience Volume 15, 655110. - Miyahara K, Nishimaru H, Matsumoto J, Setogawa T, Taguchi T, Ono T, Nishijo H. (2021)
Involvement of Parvalbumin-Positive Neurons in the Development of Hyperalgesia in a Mouse Model of Fibromyalgia.
Frontiers in Pain Research Volume 2, 627860.
公募班員 2023-2024年度
研究項目A01「行動変容のネットワークベイズモデル」
代表者:石井 信(京都大学・教授)
メンバー
| 代表者 | 石井 信(京都大学・教授) |  |
|---|
ウェブサイト
https://ishiilab.jp/member/ishii/
研究内容の概要
行動変容を、脳の基底ネットワークの変化による認識、推論、意思決定の過程の変化と定義し、その元となる基底ネットワークの変容を、ヒト脳において、機能的核磁気共鳴図(fMRI)で計測可能なレベルで定量化する。脳の内省的状態(メタ認知)との関連も探ると共に、「ベイズ脳」仮説に基づき、数理的なモデル化を進める。実験データが得られることに期待して、サル(マーモセット)においてネットワークレベルでの基底状態の定量化を試みる。
具体的には、人工知能に基づく画像変換技術GANSID(図)を応用した静止画認識課題を用いて、ヒトを含む霊長類の脳の、事前知識と刺激の統合による認識過程のモデル化を進め、特に事前知識の表象をネットワークレベルで調べる。また、人工文字当て課題を用いて、ヒトの推論と意思決定の過程における刺激の不確実性とその内省的評価がいかに推論(文字当て)に関わるのかを調べる。

文献
- Fujimoto, K., Hayashi, K., Katayama, R., Lee, S., Liang, Z., Yoshida, W., Ishii, S. (2022) Deep learning-based image deconstruction method with maintained saliency. Neural Networks 155, 224-241.
- Lee, S., Kume, H., Urakubo, H., Kasai, H., Ishii, S. (2022) Tri-view two-photon microscopic image registration and deblurring with convolutional neural networks. Neural Networks 152, 57-69.
- Katayama, R., Yoshida, Y., Ishii, S. (2022) Confidence modulates the decodability of scene prediction during partially-observable maze exploration in humans. Communications Biology 5, 367.
研究項目A01「習慣行動と目的指向行動制御の学習ダイナミクス」
代表者:鮫島 和行(玉川大学・教授)
メンバー
| 代表者 | 鮫島 和行(玉川大学・教授) |  |
|---|
ウェブサイト
https://www.tamagawa.ac.jp/teachers/samejima/
研究内容の概要
本研究では、オペラント学習の進行に伴って、強化される行動が目的指向行動と習慣行動の間で揺れ動く行動変容を題材に、動物の行動発現メカニズムを心理・神経の両面から探る。これまで、繰り返し同じ行動が強化されることで、目的指向行動から習慣行動へと移行すると考えられてきた。しかしその描像は一定ではない。訓練過程おける習慣・目標指向行動の行動変容の構造を、齧歯類・霊長類を含む複数の動物種の自由行動下で定量的に観測・分析する。また、行動動態を再現するアルゴリズムの側面から大脳皮質・大脳基底核を含む神経回路の計算過程の予測を行い、学習中の神経表現変容と行動変容との神経相関を明らかにする。
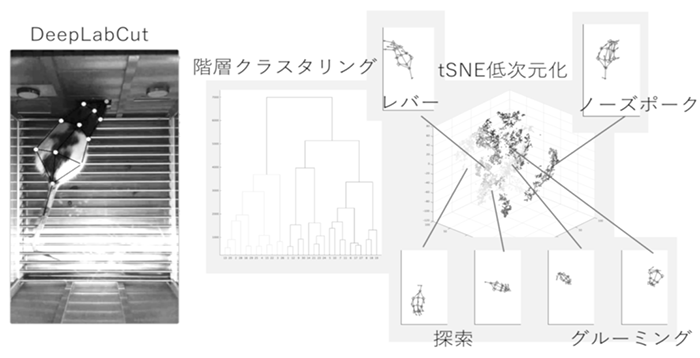
文献
- Nonomura S, Samejima K. (2019) Neuronal representation of object choice in the striatum of the monkey. Frontiers in Neuroscience 13, 1283.
- Li G, Hashimoto T, Konno T, Okuda J, Samejima K, Fujiwara M, Morita J. (2019) The mirroring of symbols: An EEG study on the role of mirroring in the formation of symbolic communication systems. Letters on Evolutionary Behavioral Science 10, 7-10.
- Nonomura S, Nishizawa K, Sakai Y, Kawaguchi Y, Kato S, Uchigashima M, Watanabe M, Yamanaka K, Enomoto K, Chiken S, Sano H, Soma S, Yoshida J, Samejima K, Ogawa M, Kobayashi K, Nambu A, Isomura Y, Kimura M. (2018) Monitoring and updating of action selection for goal-directed behavior through the striatal direct and indirect pathways. Neuron 99, 1302-1314.
研究項目A01「大脳基底核疾患における行動変容と治療による改善」
代表者:南部 篤(生理学研究所・特任研究員)
メンバー
| 代表者 | 南部 篤(生理学研究所・特任研究員) |  |
|---|---|---|
| 研究協力者 | 知見 聡美(生理学研究所・助教) | |
ウェブサイト
研究内容の概要
パーキンソン病は運動症状以外に、意欲減退やうつなどの精神症状も示す。サルを用いた動物実験では、このような精神症状は表情の変化から伺うことができる。パーキンソン病状態では、ヒト患者で仮面様顔貌と表現されるような意欲が低下した表情を示すのに対し、治療により症状が改善すると、目が爛爛と輝くなど意欲的な表情を示す。このような表情の変化に象徴される意欲の変化が、パーキンソン病からの改善という行動変容につながると考えられる。しかし、運動症状と異なり、このような表情の変化を客観的に評価することは難しい。そこで正常サル、パーキンソン病モデルサル、治療時のサルの表情の画像(動画、静止画)を撮影し、AI技術を用いて解析することによりサルの「意欲」や「やる気」などの心の状態を評価する方法を開発する。さらに、サルの身体症状、線条体のドーパミン濃度計測、淡蒼球などからの神経活動計測も同時に行い、表情や精神状態の神経基盤を明らかにする。
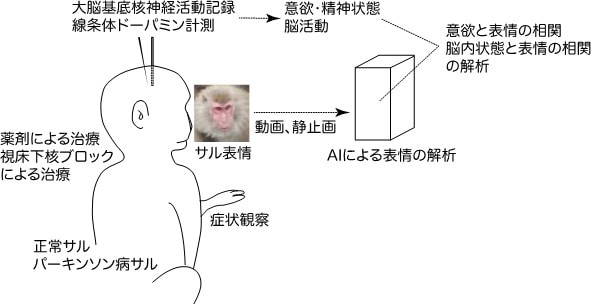
文献
- Hasegawa T, Chiken S, Kobayashi K., Nambu A. (2022) Subthalamic nucleus stabilizes movements by reducing neural spike variability in monkey basal ganglia. Nature Communications 13, 2233.
- Darbin O, Hatanaka N, Takara S, Kaneko N, Chiken S, Naritoku D, Martino A, Nambu A. (2022) Subthalamic nucleus deep brain stimulation driven by primary motor cortex γ2 activity in parkinsonian monkeys. Scientific Reports, 12, 6493.
- Chiken S, Takada M, Nambu A. (2021) Altered dynamic information flow through the cortico-basal ganglia pathways mediates Parkinson’s disease symptoms. Cerebral Cortex 31, 5363-5380.
- Wahyu I D, Chiken S, Hasegawa T, Sano H, Nambu A. (2021) Abnormal cortico-basal ganglia neurotransmission in a mouse model of l-DOPA-induced dyskinesia. Journal of Neuroscience 41, 2668-2683.
研究項目A01「発達障害における注意動態と社会行動の変容に関するメカニズム」
代表者:藤野 純也(東京科学大学・講師)
メンバー
| 代表者 | 藤野 純也(東京科学大学・講師) |  |
|---|---|---|
| 研究協力者 | 鄭 志誠(京都大学・客員研究員) | |
ウェブサイト
https://www.tmd.ac.jp/med/psyc/
研究内容の概要
注意機能は、脳内情報処理において重要な役割を担っています。私達はこれまで、注意機能の神経基盤として重要な脳領域が、どのように社会行動に関わっているのかを調べてきました。例えば、右側頭頭頂接合部(TPJ)に抑制性の反復性経頭蓋磁気刺激法(rTMS)を行うことにより、自分の属性によって柔軟な意思決定をするのが困難になること、共感性と協力行動との関連が変化することが明らかになりました。また、自閉スペクトラム症を対象に、右TPJにrTMS介入を行ったところ(下図)、抑制性rTMS後に、シャム刺激と比較して符合課題の変化量が低下し、同疾患群においても、同部位が処理速度や視空間注意機能に重要な役割を果たしていることが示唆されました。本研究課題では、行動経済学的手法・機械学習・複数のモダリティーのMRI・rTMSを組み合わせることでこれまでの研究を発展させ、注意機能の脳動態シフトとともに、意思決定や行動選択、社会場面における表情がどのように変化するかを検証します。これにより、発達特性の観点から、社会行動の変容に関するメカニズムの解明を目指します。
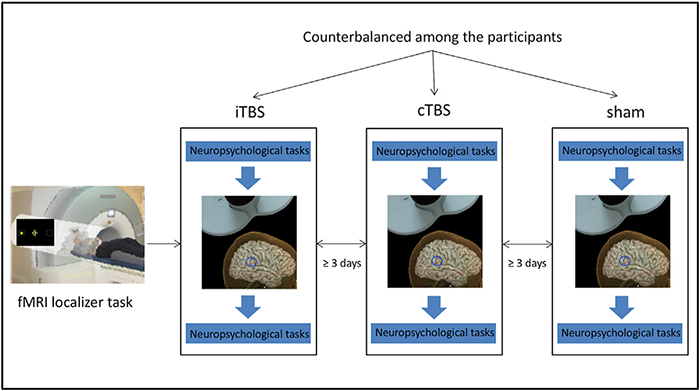
文献
- Fujino J, Tei S, Itahashi T, Aoki YY, Ohta H, Izuno T, Nakamura H, Shimizu M, Hashimoto RI, Takahashi H, Kato N, Nakamura M. (2021) A single session of navigation-guided repetitive transcranial magnetic stimulation over the right anterior temporoparietal junction in autism spectrum disorder. Brain Stimul. 14, 682-684.
- Tei S, Tanicha M, Itahashi T, Aoki YY, Ohta H, Qian C, Hashimoto RI, Nakamura M, Takahashi H, Kato N, Fujino J. (2022) Decision flexibilities in autism spectrum disorder: an fMRI study of moral dilemmas. Soc. Cogn. Affect. Neurosci. 17, 904-911.
- Fujino J, Tei S, Itahashi T, Aoki YY, Ohta H, Kubota M, Hashimoto RI, Takahashi H, Kato N, Nakamura M. (2020) Role of the right temporoparietal junction in intergroup bias in trust decisions. Hum. Brain Mapp. 41, 1677-1688.
- Tei S, Kauppi JP, Jankowski KF, Fujino J, Monti RP, Tohka J, Abe N, Murai T, Takahashi H, Hari R. (2020) Brain and behavioral alterations in subjects with social anxiety dominated by empathic embarrassment. Proc. Natl. Acad. Sci. USA. 117, 4385-4391.
研究項目A01「霊長類の意思決定を変容する潜在意識下の脳動態」
代表者:松本 正幸(京都大学・教授)
メンバー
| 代表者 | 松本 正幸(京都大学・教授) |  |
|---|
ウェブサイト
研究内容の概要
我々は外界の情報を知覚し、その情報を基に適切な行動を選択する。一方、ヒトを対象にした先行研究は、知覚に上らない潜在意識下の情報が意思決定に影響することも報告している。ただ、侵襲的な実験手法が利用可能な実験動物を対象にした先行研究は見られず、潜在意識下にある情報がどのような神経メカニズムで意思決定に反映されるのかは不明である。本研究では、マカクザルを対象に、知覚することが難しい条件で視覚刺激を提示し、この刺激の情報を基に選択肢の中から一つを選ぶ意思決定課題を考案した。そして、サルが視覚刺激を知覚できないとき、知覚的意識を伴わない潜在意識下の情報がサルの意思決定に与える影響を解析するとともに、意思決定に関連した情動や動機づけを反映する生理・行動指標を計測する。同時に、意思決定に関わる眼窩前頭皮質、線条体、ドーパミンニューロンの神経活動を記録、操作する。本研究の成果は、潜在意識下の情報に基づく意思決定の生物学的基盤を明らかにし、意思決定を支える神経メカニズム全体像の理解につながると期待される。
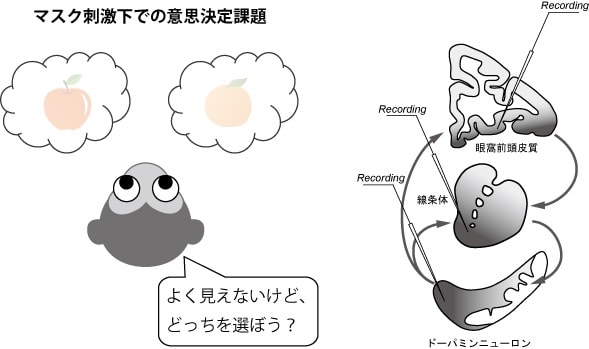
文献
- Wang Y, Toyoshima O, Kunimatsu J, Yamada H, Matsumoto M. (2021) Tonic firing mode of midbrain dopamine neurons continuously tracks reward values changing moment-by-moment. Elife 10, e63166.
- Yun M, Kawai T, Nejime M, Yamada H, Matsumoto M. (2020) Signal dynamics of midbrain dopamine neurons during economic decision-making in monkeys. Science Advances 6, eaba4962.
- Ogasawara T, Nejime M, Takada M, Matsumoto M. (2018) Primate nigrostriatal dopamine system regulates saccadic response inhibition. Neuron 100, 1513-26.
研究項目A01「光遺伝学を用いた視覚情報の伝播解析と行動変容による脳動態変化解明」
代表者:村上 知成(東京大学・助教)
メンバー
| 代表者 | 村上 知成(東京大学・助教) |  |
|---|
ウェブサイト
https://researchmap.jp/tmnr-mrkm
研究内容の概要
我々が認識する自身の内因的状態は、外界からの感覚情報入力によって大きく影響を受ける。脳の神経ネットワークによって処理された感覚情報はモチベーションや達成感などの感情を生み出す助けとなり、この内因的な状態の向上が行動変容の促進に重要であると考えられる。しかしながら、哺乳類の脳において感覚情報がどのように処理されるのか、そして行動変容の過程において感覚情報処理を含む脳動態がどのように変化するのかよくわかっていない。そこで本研究では、マウス視覚野で視覚情報がどのように伝播するかをまず明らかにする。そして次に課題学習により行動変容が起きているときに、視覚情報処理経路でどのような活動変化が起こっているかを検証する。さらに本研究で用いる光刺激+生体イメージングの実験系は総括班の研究計画にある発達や老齢、疾患マウスの行動変容過程においても導入可能であり、脳動態と行動変容の大域情報フローをより因果的に解明することに貢献したい。
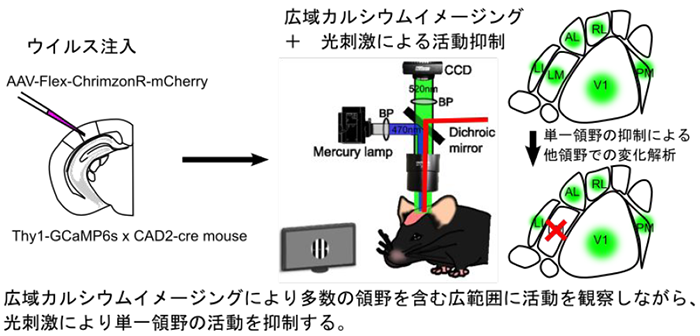
文献
- Murakami T, Ohki K. (2023) Thalamocortical circuits for the formation of hierarchical pathways in the mammalian visual cortex. Frontiers in Neural Circuits 17, 1155195.
- Murakami T, Matsui T, Uemura M, Ohki K. (2022) Modular strategy for development of the hierarchical visual network in mice. Nature 608, 578-585.
- Murakami T, Matsui T, Ohki K. (2017) Functional Segregation and Development of Mouse Higher Visual Areas. Journal of Neuroscience 37, 9424-9437.
- Murakami T, Yoshida T, Matsui T, Ohki K. (2015) Wide-field Ca2+ imaging reveals visually evoked activity in the retrosplenial area. Frontiers in Molecular Neuroscience 8, 20.
研究項目A01「行動変容の創発における前障-大脳皮質広域ネットワークの動態解明」
代表者:吉原 良浩(理化学研究所・チームリーダー)
メンバー
| 代表者 | 吉原 良浩(理化学研究所・チームリーダー) |  |
|---|
ウェブサイト
https://cbs.riken.jp/jp/faculty/y.yoshihara/
研究内容の概要
安静状態におけるDefault Mode Network、顕著な刺激の抽出を担うSalience Network、随意運動発現などの実行機能を生み出すCentral Executive Networkなど、大脳皮質には機能連関する領野間の情報伝達・処理を行う複数の広域ネットワークが存在する。行動変容を創発する脳ダイナミクスの神経回路基盤として、これら異なる広域ネットワークが迅速かつ正確に切り替わることが重要な役割を果たすと考えられるが、その動作メカニズムは未だ解明されていない。前障(Claustrum)は哺乳類の大脳皮質の内側に存在する薄いシート状の構造であり、すべての大脳皮質領野と双方向性に神経結合するユニークな脳領域である。私たちは最近、前障ニューロン特異的にDNA組換え酵素Creを発現するトランスジェニックマウス系統を樹立し、前障が大脳皮質の広範な領域において同期的な静止状態を引き起こすことによって、徐波活動を制御することを見出した。このような解剖学的・生理学的特徴から前障は、大脳皮質広域ネットワークの切り替えを行うのに適した脳領域であると推定される。そこで本研究では、前障の異なるニューロンタイプにCreあるいはtTAを発現する3種類のマウス系統を用い、行動学・光/化学遺伝学・生理学・解剖学など多様な実験手法を統合的に組み合わせ、行動変容の創発における前障の機能解析および前障−大脳皮質広域ネットワーク動態解明に挑戦する。
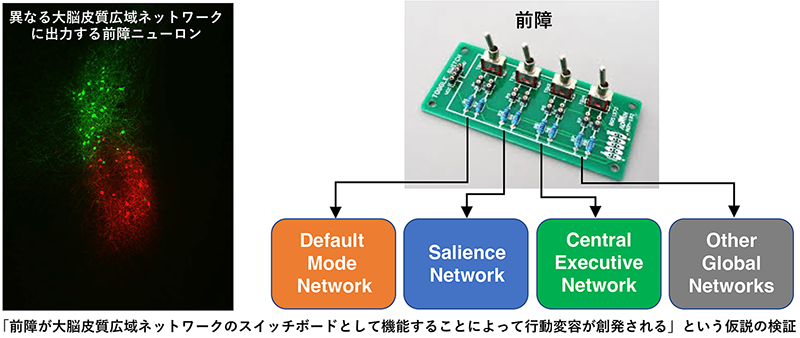
文献
- Narikiyo K, Mizuguchi R, Ajima A, Mitsui S, Shiozaki M, Hamanaka H, Johansen JP, Mori K, Yoshihara Y. (2020) The claustrum coordinates cortical slow-wave activity. Nature Neuroscience 23, 741-753.
- Furutani Y, Yoshihara Y. (2018) Proteomic analysis of dendritic filopodia-rich fraction isolated by telencephalin and vitronectin interaction. Frontiers in Synaptic Neuroscience 10, 27.
- Wakisaka N, Miyasaka N, Koide T, Masuda M, Hiraki-Kajiyama T, Yoshihara Y. (2017) An adenosine receptor for olfaction in fish. Current Biology 27, 1437-1447.
- Yabuki Y, Koide T, Miyasaka N, Wakisaka N, Masuda M, Ohkura M, Nakai J, Tsuge K, Tsuchiya S, Sugimoto Y, Yoshihara Y. (2016) Olfactory receptor for prostaglandin F2α mediates male fish courtship behavior. Nature Neuroscience 19, 897-904.
研究項目A02「柔軟な行動変容に必要な情報選択の神経メカニズムの解明」
代表者:宇賀 貴紀(山梨大学・教授)
メンバー
| 代表者 | 宇賀 貴紀(山梨大学・教授) |  |
|---|---|---|
| 研究協力者 |
熊野 弘紀(山梨大学・助教) 須田 悠紀(山梨大学・助教) |
|
ウェブサイト
https://www.med.yamanashi.ac.jp/basic/integphys/
研究内容の概要
環境に応じて柔軟に判断を切り替えるタスクスイッチングは、ヒトを含めた霊長類特有の適応的な認知機能である。我々はこれまで、2つの環境(ルール)に応じて柔軟に判断を切り替えるタスクスイッチ課題を世界ではじめてサルに適用し(Sasaki & Uka, Neuron, 2009)、柔軟な行動変容の神経メカニズムを解明してきた(Kumano, Suda & Uka, J Neurosci, 2016; Sasaki et al., Cereb Cortex, 2022; Suda & Uka, Commun Biol, 2022)。これらの結果から、柔軟な判断に「どの」情報を収集するのかを制御するシステムが大きく関わっていることが明らかになってきた。本研究では、柔軟な行動変容に必須である情報収集と情報選択の制御機構を解明することを目的とする。そのため、情報選択の制御に重要と考えらえる前頭前野の広域脳動態情報を明らかにし、情報収集に特化した感覚-判断の局所脳動態情報との相互作用を明らかにする。

文献
- Suda Y, Uka T. (2022) The NMDA receptor antagonist ketamine impairs and delays context-dependent decision making in the parietal cortex. Commun Biol 5, 690.
- Sasaki R, Kumano H, Mitani A, Suda Y, Uka T. (2022) Task-specific employment of sensory signals underlies rapid task switching. Cereb Cortex 32, 4657-4670.
- Kumano H, Suda Y, Uka T. (2016) Context-dependent accumulation of sensory evidence in the parietal cortex underlies flexible task switching. J Neurosci 36, 12192–12202.
研究項目A02「逆転学習後の正しい解法への“気づき”に関わる脳内動態と神経機構」
代表者:奥野 浩行(鹿児島大学・教授)
メンバー
| 代表者 | 奥野 浩行(鹿児島大学・教授) |  |
|---|
ウェブサイト
https://www3.kufm.kagoshima-u.ac.jp/biochem2/
研究内容の概要
外的要因が変化した際、それまでの行動ルールから新たな行動ルールへ速やかに切り替えを行う能力は行動柔軟性あるいは認知的柔軟性と呼ばれている。繰り返し逆転学習課題はマウスにおける行動柔軟性を評価する方法の一つであり、被検マウスはトライ&エラーを繰り返しながら正しいルールに従った行動をとるように収束していく。本研究ではマウスが陥る多様なエラーパターンを解析することにより、報酬逆転課題においてルール切り替え後に生じるエラーから正解に至る行動の変容を司る神経機構をあきらかにする。行動記録の画像解析から柔軟的行動要素を切り分け、それらに関わる神経回路や細胞群を全脳マッピングなどにより同定し、さらに神経活動のイメージングや操作を行うことにより、正しい解法の"気づき"の神経機構の解明をめざす。
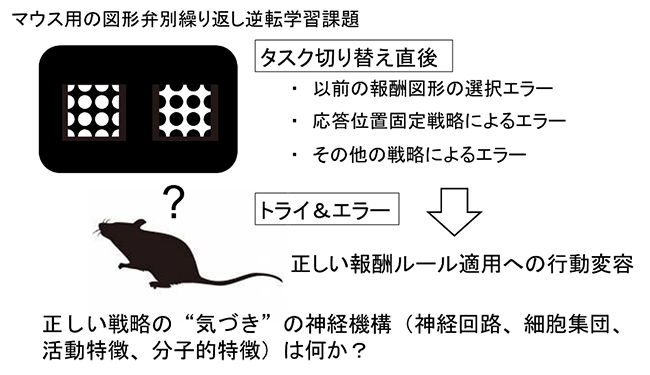
文献
- Takakura M, Nakagawa R, Ota T, Kimura Y, Yung MNG, Alia AG, Okuno H, Hirano Y. (2021) Rpd3/CoRest-mediated activity-dependent transcription regulates the flexibility in memory updating in Drosophila. Nat Commun 12, 628.
- Okuno H, Minatohara K, Bito H. (2018) Inverse synaptic tagging: An inactive synapse-specific mechanism to capture activity-induced Arc/arg3.1 and to locally regulate spatial distribution of synaptic weights. Semin Cell Dev Biol 77, 43-50.
研究項目A02「発達期の局所脳形成異常に伴う社会行動の変容とその基盤となる広域脳動態の解明」
代表者:川口 大地(東京大学・准教授)
メンバー
| 代表者 | 川口 大地(東京大学・准教授) |  |
|---|
ウェブサイト
https://molbio.f.u-tokyo.ac.jp/
研究内容の概要
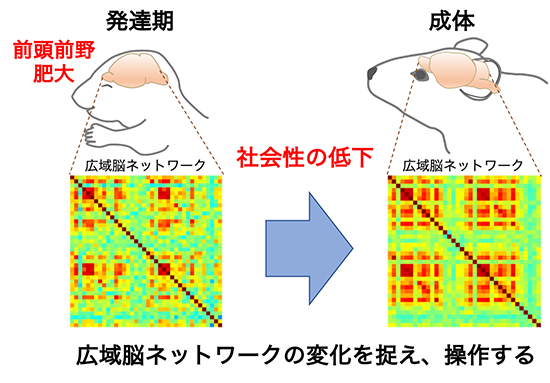
社会性行動は集団社会に適応するために重要な脳機能である。しかし、社会性を担う神経ネットワークやその構築過程については不明な点が多い。自閉症は社会性低下等を主徴とする神経発達障害であり、自閉症における広域脳ネットワークの特徴を抽出することができれば、社会性行動の責任回路や回路構築のメカニズムの理解に繋がることが考えられる。これまでの報告から、一部の自閉症児において前頭前野など脳局所の肥大が観察されている。肥大は発達期に一過的に起こることも知られている。発達期は神経回路の可塑性が大きいため、局所脳肥大が何らかの神経ネットワーク構築過程に変化を引き起こすことで社会性低下等の行動変容に繋がっている可能性が考えられる。本研究では、独自に開発した発達期の前頭前野肥大と成体の社会性行動変容を示す自閉症モデルマウスを用い、肥大を基点とする神経ネットワーク変化を全脳レベルで捉えることで、社会性行動変容の基盤となる広域脳動態の解明を目指す。
文献
- Harada Y, Yamada M, Imayoshi I, Kageyama R, Suzuki Y, Kuniya T, Furutachi S, Kawaguchi D, Gotoh Y. (2021) Cell cycle arrest determines adult neural stem cell ontogeny by an embryonic Notch-nonoscillatory Hey1 module. Nature Communications 12, 6562.
- Lanjakornsiripan D, Pior BJ, Kawaguchi D, Furutachi S, Tahara T, Katsuyama Y, Suzuki Y, Fukazawa Y, Gotoh Y. (2018) Layer-specific morphological and molecular differences in neocortical astrocytes and their dependence on neuronal layers. Nature Communications 9, 1623.
- Kawaguchi D, Sahara S, Zembrzycki A, O’Leary DDM. (2016) Generation and analysis of an improved Foxg1-IRES-Cre driver mouse line. Developmental Biology 412, 139-147.
- Kawaguchi D, Furutachi S, Kawai H, Hozumi K, Gotoh Y. (2013) Dll1 maintains quiescence of adult neural stem cells and segregates asymmetrically during mitosis. Nature Communications 4, 1880.
研究項目A02「運動学習時の行動変容にまつわる大脳皮質一次運動野の神経回路再編成」
代表者:窪田 芳之(生理学研究所・准教授)
メンバー
| 代表者 | 窪田 芳之(生理学研究所・准教授) |  |
|---|
ウェブサイト
http://www.nips.ac.jp/circuit/
研究内容の概要
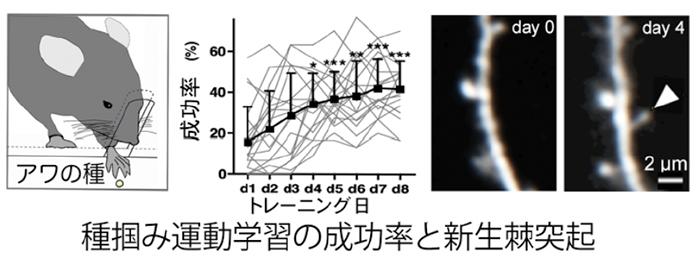
我々が環境に順応し生きていくための重要な脳機能のひとつとして、学習・記憶機能がある。これまで、多くの優れた記憶学習に関する研究報告がある。例えば記憶に重要な役割をもつ分子や、個々のシナプスの可塑的な形態変化などの記憶に関する多くの重要な知見が明らかになっている。私たちは、それらの知見をつなぎあわせ、神経回路レベルの記憶処理過程に焦点を当て研究を進める。マウスにタネ掴み運動学習課題(図)を課し、大脳皮質5層錐体細胞のタフト樹状突起上の棘突起の新生と消失などの動態を生体観察解析したところ、消失あるいは安定化(増大化)するという全く正反対の運命をもつ2種類の棘突起が大脳皮質一次運動野で新たに生じることを見出した。すなわち、一次運動野で2段階の神経回路リモデリングが起きることにより、運動学習が成立したと理解できる。そのメカニズムの解明をすすめ、脳神経回路ダイナミクスと行動変容の相関解析を目指したい。
文献
- Sohn J, Suzuki M, Youssef M, Hatada S, Larkum ME, Kawaguchi Y, Kubota Y. (2022) Presynaptic supervision of cortical spine dynamics in motor learning. Science Advances 8, eabm0531.
- Fang L, Monroe F, Novak SW, Kirk L, Schiavon CR, Yu SB, Zhang T, Wu M, Kastner K, Latif AA, Lin Z, Shaw A, Kubota Y, Mendenhall J, Zhang Z, Pekkurnaz G, Harris K, Howard J, Manor U. (2021) Deep learning based point-scanning super-resolution imaging. Nature Methods 18, 406–416.
- Kubota Y, Sohn J, Hatada S, Schurr M, Straehle J, Gour A, Neujahr R, Miki T, Mikula S, Kawaguchi Y. (2018) A carbon nanotube tape for serial-section electron microscopy of brain ultrastructure. Nature Communications 9, 437.
研究項目A02「新規個体へ社会的接触を調節する扁桃体ニューロンのシングルセルイメージング」
代表者:征矢 晋吾(筑波大学・助教)
メンバー
| 代表者 | 征矢 晋吾(筑波大学・助教) |  |
|---|
ウェブサイト
https://researchmap.jp/blot455slow975
研究内容の概要
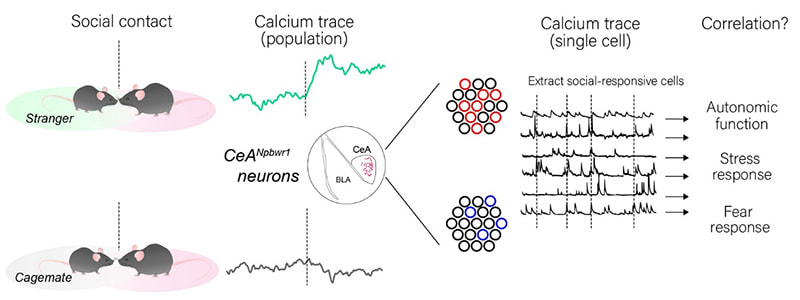
社会性は恐怖の対象となり得る他者とのソーシャルディスタンスを縮めるプロセスを必要とするが、物理的距離と情動応答が扁桃体でどのように統合され、制御されているのかは不明である。また、適切なソーシャルディスタンスの制御不全は、コミュニケーション障害から対人恐怖症まで、社会性に関わる様々な問題を引き起こす原因と考えられる。本研究では、新規神経ペプチドNPB/Wの受容体であるNpbwr1に焦点を当て、主に扁桃体中心核(CeA)に発現するNPBWR1が制御する神経回路の同定およびそのイメージングを行うことで、ソーシャルディスタンスの調節におけるNPBWR1発現ニューロンの役割を明らかにする。
これまでに、ファイバーフォトメトリーを用いて扁桃体のNpbwr1発現ニューロン(Npbwr1ニューロン)のカルシウムイメージングを行った結果、新規個体との接触時に活動が高まる一方で既知の個体に対しては活動の増加が見られなかった(未発表)。また、CeAのニューロンは多様な遺伝子マーカーを発現するヘテロな細胞集団であることから、社会行動時におけるNpbwr1ニューロンのシングルセルイメージングを行うことで新規個体を認識する活動パターンを抽出するとともにその機能的多様性について検証する。
文献
- Uchida S, Soya S, Saito YC, Hirano A, Koga K, Tsuda M, Abe M, Sakimura K, Sakurai T. (2021) A discrete glycinergic neuronal population in the ventromedial medulla that induces muscle atonia during REM sleep and cataplexy in mice. Journal of Neuroscience 17, 1582-1596.
- Takahashi TM, Sunagawa GA, Soya S, Abe M, Sakurai K, Ishikawa K, Yanagisawa M, Hama H, Hasegawa E, Miyawaki A, Sakimura K, Takahashi M, Sakurai T. (2020) A discrete neuronal circuit induces a hibernation-like state in rodents. Nature 583, 109-114.
- Soya S, Takahashi TM, Mchugh T, Maejima T, Abe M, Sakimura S, Sakurai T. (2017) Orexin modulates behavioral fear expression through locus coeruleus. Nature Communications 8, 1-14.
研究項目A02「慢性疼痛の中枢性感作による行動変容の神経機構解明」
代表者:西丸 広史(富山大学 ・教授)
メンバー
| 代表者 | 西丸 広史(富山大学 ・教授) |  |
|---|
ウェブサイト
https://researchmap.jp/nishimaru
研究内容の概要
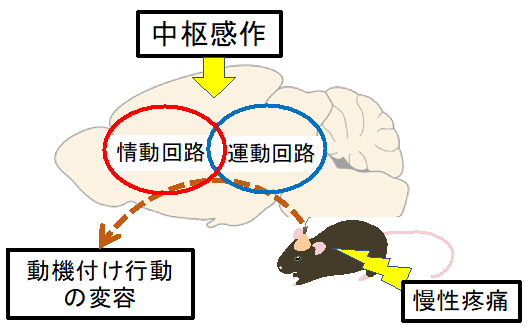
動物にとって有害な刺激を痛覚として受容し反応する機能は、個体の生存と種の保存には極めて重要である。その一方で、ヒトの様々な疾患に起因する慢性的な疼痛は、意欲の低下をはじめとして生活の質を大きく低下させる。日本国内においては、2000万人以上(約5人に1人)がなんらかの慢性痛を持っていると推計されており社会問題となっている。さらに慢性疼痛患者が気分障害・パニック障害などなんらかの精神疾患を併発する割合は、非患者と比べて約2〜3倍ほどと報告されている。このことから、この両者には共通した病態機構が存在していることが考えられているが、近年、脳の感覚関連領野の機能の異常により脳内で疼痛情報が異常に増幅される「中枢性感作」という現象が重要な鍵であることが提唱されている。さらに、この中枢性感作が感覚情報処理を司る領域のみならず、情動関連領野および運動関連領野にも影響を及ぼしている可能性があると考えられている。本課題では慢性疼痛および抑うつ症状を再現できる実験モデルマウスにおいて、動機付け行動の学習およびその遂行中に、情動発現と運動制御に重要な神経ネットワークから広範囲に多数の神経細胞の活動を測定・解析する。これにより動機付け行動の学習と遂行への慢性疼痛による行動変容について、情動と運動の二つの神経回路における情報表現を明らかにすることを目的とする。
文献
- Nishimaru H, Matsumoto J, Setogawa T, Nishijo H. (2023) Neuronal structures controlling locomotor behavior during active and inactive motor states. Neuroscience Research Volume 189, 83-93.
- Sachuriga, Nishimaru H, Takamura Y, Matsumoto J, Mariana Ferreira Pereira de Araújo, Ono T, Nishijo H. (2021) Neuronal Representation of Locomotion During Motivated Behavior in the Mouse Anterior Cingulate Cortex. Frontiers in System Neuroscience 15, 655110.
- Miyahara K, Nishimaru H, Matsumoto J, Setogawa T, Taguchi T, Ono T, Nishijo H. (2021) Involvement of Parvalbumin-Positive Neurons in the Development of Hyperalgesia in a Mouse Model of Fibromyalgia. Frontiers in Pain Research 2, 627860.
研究項目A02「レジリエンスを導く多次元行動変容を創発する脳内ネットワークの解明」
代表者:林 悠(東京大学・教授)
メンバー
| 代表者 | 林 悠(東京大学・教授) |  |
|---|
ウェブサイト
https://hayashi-sleep-lab.net/
研究内容の概要
長期的なストレスは脳や全身に作用し、多元的な行動変容を惹起するが、その表れ方は個体ごとに多様である。ストレス社会と言われる現代において心身ともに健康を保つ上で、生物が本来持つレジリエンス(ストレス抵抗性)の神経基盤を理解することが鍵となる。本研究ではストレスがもたらす行動変容の内、睡眠および社会性に関連した行動に注目する。ストレスがこうした行動に影響を及ぼすことはよく知られており、それぞれの行動を制御する神経回路の変容がその原因と予想される。本研究では、睡眠を制御する神経回路が惹起する脳の広域の脳動態が、ストレスにより変容した結果、社会性行動を制御する神経回路の局所動態に影響が生じて、社会性に関連する行動変容をもたらす可能性を検証するとともに、そのメカニズムを追求する。そのために、ストレス下での睡眠制御回路やその標的領域への人為的介入の効果を調べる。本研究により、ストレスによって抑うつ状態が形成される過程や、それに対して脳が備えた防衛機構について、広域の脳動態と局所的な脳動態の相互作用に注目することで、構成的な理解を目指す。
文献
- Kawano T, Kashiwagi M, Kanuka M, Chen CK, Yasugaki S, Hatori S, Miyazaki S, Tanaka K, Fujita H, Nakajima T, Yanagisawa M, Nakagawa Y, Hayashi Y. (2023) ER proteostasis regulators cell-non-autonomously control sleep. Cell Reports 42, 112267.
- Tsai CJ, Nagata T, Liu CY, Suganuma T, Kanda T, Miyazaki T, Liu K, Saitoh T, Nagase H, Lazarus M, Vogt K, Yanagisawa M, Hayashi Y. (2021) Cerebral capillary blood flow upsurge during REM sleep is mediated by A2A receptors. Cell Reports 36, 109558.
- Kashiwagi M, Kanuka M, Tatsuzawa C, Suzuki H, Morita M, Tanaka K, Kawano T, Shin JW, Suzuki H, Itohara S, Yanagisawa M, Hayashi Y. (2020) Widely distributed neurotensinergic neurons in the brainstem regulate NREM sleep in mice. Current Biology 30, 1002-1010.
- Hayashi Y, Kashiwagi M, Yasuda K, Ando R, Kanuka M, Sakai K, Itohara S. (2015) Cells of a common developmental origin regulate REM/non-REM sleep and wakefulness in mice. Science 350, 957-61.
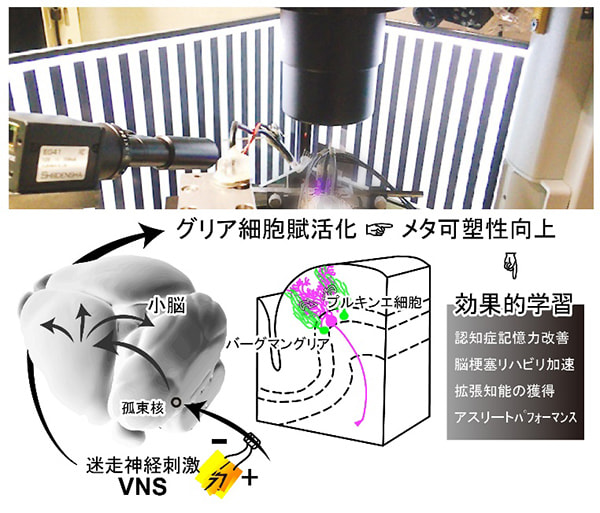
研究項目A02「末梢-中枢機能連関による脳内環境とメタ可塑性制御」
代表者:松井 広(東北大学・教授)
メンバー
| 代表者 | 松井 広(東北大学・教授) |  |
|---|
ウェブサイト
http://www.ims.med.tohoku.ac.jp/matsui/
研究内容の概要
迷走神経は、身体・末梢を脳・中枢へとつなぐ天然のアクセスルートとみなすことができ、迷走神経への刺激を工夫することで、脳内環境を自在に遠隔操作することが可能となる。本研究では、頸部迷走神経の求心性刺激によって、中枢グリア細胞の機能を賦活化し、脳内メタ可塑性を向上させることで、生来の性能を超えた学習・記憶機能を実装することを目指す。迷走神経からの求心性の信号は、まずは孤束核に伝えられ、孤束核を介して脳内の様々な部位に迷走神経由来の感覚情報が送られる。ファイバーフォトメトリー法を用いて脳深部アストロサイト、蛍光マクロ実体顕微鏡の広域イメージングを用いて、小脳を含む全脳皮質表面のアストロサイトの記録をしたところ、迷走神経刺激によってアストロサイトに活動が引き起こされることが示された。求心性の迷走神経刺激が中枢のアストロサイトの活動を賦活化し、学習や記憶にともなう可塑性の成立しやすさ=メタ可塑性が向上するというメカニズムが示唆された。そこで、本研究では、迷走神経刺激による行動変容・メタ可塑性制御のメカニズムを解き明かすことに挑戦する。マウスを用いたいくつかの学習課題をモデルとして、迷走神経刺激とグリア-神経機能連関等の細胞生理学的なメカニズムとの関連を明らかにする。
文献
- Ikoma Y, Takahashi Y, Sasaki D, Matsui K. (2023) Properties of REM sleep alterations with epilepsy. Brain, in press.
- Ikoma Y, Sasaki D, Matsui K. (2023) Local brain environment changes associated with epileptogenesis. Brain 146, 576-586.
- Morizawa YM, ..., Matsui K. (2022) Synaptic pruning through glial synapse engulfment upon motor learning. Nature Neuroscience 25, 1458-1469.
- Shimoda Y, …, Matsui K. (2022) Optogenetic stimulus-triggered acquisition of seizure resistance. Neurobiology of Disease 163, 105602.
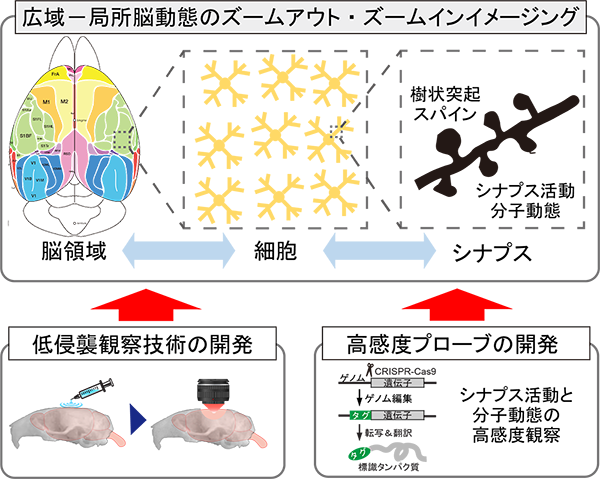
研究項目A02「広域-局所脳動態イメージングのための汎用的技術基盤の開発」
代表者:三國 貴康(新潟大学・教授)
メンバー
| 代表者 | 三國 貴康(新潟大学・教授) |  |
|---|
ウェブサイト
https://www.bri.niigata-u.ac.jp/field/cellneu/
研究内容の概要
動物の脳内で行動変容を司る神経細胞を同定し、その細胞でのシナプス活動や機能分子の動態を知ることができれば、行動変容における広域-局所脳動態を極めて高い解像度で理解できる。脳の広域-局所の光学的イメージングは広域脳動態と局所脳動態の相互作用を理解する上で非常に有用であるが、広域観察のために頭蓋骨の大半を切除する従来の方法では動物への侵襲が大きすぎる問題があり、また、特殊で高価な顕微鏡を必要とする技術的およびコスト的な問題がある。そこで本研究では、頭蓋骨を除去することなく低侵襲に脳内をライブイメージングするための技術を開発し、さらに、高感度にシナプス活動や分子動態をイメージングするためのプローブ群を開発する。本研究で開発する低侵襲脳内イメージング技術と高感度プローブ群を組み合わせることで、生体脳内の広域-局所脳動態を低侵襲かつ高解像度にイメージングするための汎用的な技術プラットフォームを提供でき、様々な行動変容に伴う広域脳動態と局所脳動態の相互作用を迅速、簡便かつ高精度に理解できるようになる。
文献
- Mikuni T, Uchigashima M. (2021) Methodological approaches to understand the molecular mechanism for structural plasticity of dendritic spines. Eur J Neurosci 54, 6902-11.
- Nishiyama J, Mikuni T, Yasuda R. (2017) Virus-mediated genome editing via homology-directed repair in mitotic and postmitotic cells in mammalian brain. Neuron 96, 755-68.
- Mikuni T, Nishiyama J, Sun Y, Kamasawa N, Yasuda R. (2016) High-throughput, high-resolution mapping of protein localization in mammalian brain by in vivo genome editing. Cell 165, 1803-17.
- Mikuni T, Uesaka N, Okuno H, Hirai H, Deisseroth K, Bito H, Kano M. (2013) Arc/Arg3.1 is a postsynaptic mediator of activity-dependent synapse elimination in the developing cerebellum. Neuron 78, 1024-35.
研究項目A02「行動変容を規定する睡眠時の広域-局所脳動態」
代表者:宮脇 寛行(大阪公立大学・講師)
メンバー
| 代表者 | 宮脇 寛行(大阪公立大学・講師) |  |
|---|
ウェブサイト
https://researchmap.jp/hmiyawaki
研究内容の概要
動物は様々な入力情報を統合し行動を決定しているが、同じ状況に置かれた場合であっても、経験をもとに行動を変容させる。このような行動変容が表出するためには、それに先立ち、様々な情報を統合する広域脳ネットワークが変化することが必要であると考えられる。研究代表者らはこれまでに、行動を変化させる経験後の睡眠中には、脳領域横断的な同期活動が新たに生じるようになり、同様の同期活動がその経験を想起する際にも生じることを明らかにした。さらに、脳波に見られる高周波数のオシレーション活動が、局所ネットワークの変化や脳領域横断的な同期活動に深く関わっていることも発見している。そこで本研究では、経験依存的に行動を変容させる課題をラットに学習させ、学習中ならびにその前後の睡眠中の脳活動を他領域同時・大規模電気生理学を用い記録することで行動変容にともなう局所-広域脳動態の変化を明らかにする。さらに、光遺伝学を用いた神経活動への介入を行い、行動変容に必要な脳動態の変化を制御する神経メカニズムを解明することを目指す。

文献
- Mizuseki K, Miyawaki H. (2023) Fast network oscillations during non-REM sleep support memory consolidation Neuroscience Research 189, 3-12.
- Miyawaki H, Mizuseki K. (2022) De novo inter-regional coactivations of preconfigured local ensembles support memory. Nature Communications 13, 1272.
- Miyawaki H, Diba K. (2016) Regulation of Hippocampal Firing by Network Oscillations during Sleep. Current Biology 26, 893-902.
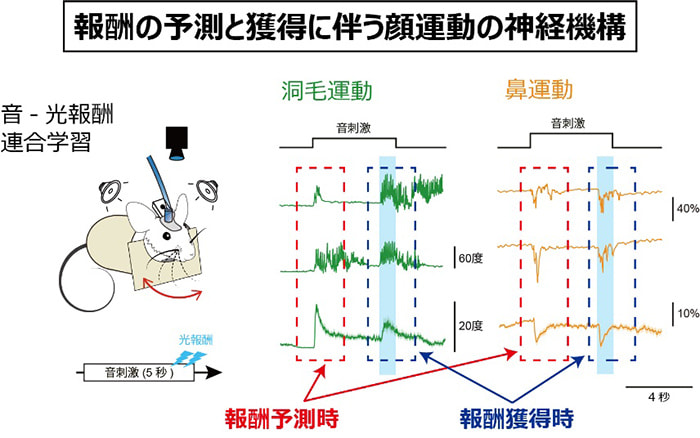
研究項目A02「報酬関連の顔運動を表象する脳神経機構の多次元解析」
代表者:山下 貴之(藤田医科大学・教授)
メンバー
| 代表者 | 山下 貴之(藤田医科大学・教授) |  |
|---|
ウェブサイト
研究内容の概要
プレゼントが入った袋を開けようとする子供の表情は期待に満ちています。その表情は、プレゼントの内容に満足した時の笑顔とは全く異なることを私たちは知っています。しかしながら、このように動物が状況に応じて見せる多彩な表情がどのような神経機構により形成されるかは十分に解明されていません。私たちは、最近、マウスが報酬を予測した時と報酬を獲得した時に異なる特徴を持つ顔運動を示すことを発見しました(Li et al., bioRxiv, 2022)。そして、大脳皮質一次運動野がこれらの報酬関連の顔運動を表象するのみならず、これらの運動の発現に不可欠であることも明らかにしつつあります。このような報酬関連の顔運動は学習により強化あるいは繰り返しにより減弱します。本研究では、大脳皮質一次運動野の神経活動動態に着目し、最新の多次元的解析手法を活用しながら、報酬に関連した顔運動が脳内でどのように表現され、どのように変化するのかを明らかにすることを目的としています。
文献
- Li W, Nakano T, Mizutani K, Kawatani M, Matsubara T, Danjo T, Mukai Y, Yamanaka A, Ito H, Aizawa H, Petersen CCH, Yoshimoto J, Yamashita T. (2022) Primary motor cortex drives expressive facial movements related to reward processing in mice. bioRxiv, doi: https://doi.org/10.1101/2022.10.28.514159
- Matsubara T, Yanagida T, Kawaguchi N, Nakano T, Yoshimoto J, Sezaki M, Takizawa H, Tsunoda SP, Horigane S, Ueda S, Takemoto-Kimura S, Kandori H, Yamanaka A, Yamashita T. (2021) Remote control of neural function by X-ray-induced scintillation. Nature Communications 12, 4478.
- Yamashita T, Petersen CCH. (2016) Target-specific membrane potential dynamics of neocortical projection neurons during goal-directed behavior. eLife 5, e15798.
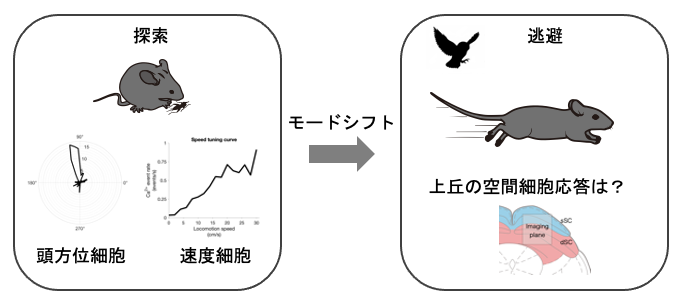
研究項目A02「探索から逃避へのモードシフトを創発する上丘の空間細胞ダイナミクス」
代表者:米原 圭祐(国立遺伝学研究所・教授)
メンバー
| 代表者 | 米原 圭祐(国立遺伝学研究所・教授) |  |
|---|
ウェブサイト
https://www.nig.ac.jp/nig/ja/research/organization-top/laboratories/yonehara
研究内容の概要
動物の生存に重要な生得的行動の多くにとって、行動を起こす位置や方位が重要である。例えば、動き回る餌を捕獲するためには餌の方向へ動く必要があり、天敵が襲ってきた時はそれと反対方向ないしは安全なシェルターの方向へ素早く逃避する必要がある。しかし、これらの正確な定位行動の基盤となる脳動態は不明である。一方で、探索行動中の齧歯類の脳から場所細胞や頭方位細胞、グリッド細胞、速度細胞など空間認知に関わるとされる様々な神経細胞が同定されてきたが、これらの細胞の捕食や逃避などにおける定位行動との関連は不明である。我々は最近、逃避行動を仲介する脳部位であるマウス上丘に場所細胞や速度細胞を同定した。本研究ではこれらの空間細胞を含めた上丘細胞が探索行動から逃避行動へ切り替わる際にどのような活動変化を示すのかを超小型内視鏡によるカルシウムイメージング、ビデオ撮影とDeepLabCutによる運動や姿勢の定量的解析、機械学習による多次元データ解析を組み合わせて明らかにする。本研究により探索行動から逃避行動へのモードシフトという柔軟性に富んだ行動変容の基盤となる脳動作原理の理解が進む。
文献
- Matsumoto A, et al. (2021) Direction selectivity in retinal bipolar cell axon terminals. Neuron 109, 2928-2942.
- Sethuramanujam S, et al. (2021) Rapid ´multi-directed´ cholinergic transmission at central synapses. Nat Commun 12, 1374.
- Rasmussen R, et al. (2021) Binocular integration of retinal motion information underlies optic flow processing by the cortex. Curr Biol 31, 1165-1174.
- Rasmussen R, et al. (2020) A segregated cortical stream for retinal direction selectivity. Nat Commun 11, 831.
研究項目A02「認知バイアスを介した不確定性下の行動変容機構の解明」
代表者:渡邉 大(京都大学・教授)
メンバー
| 代表者 | 渡邉 大(京都大学・教授) |  |
|---|
ウェブサイト
https://phy.med.kyoto-u.ac.jp/
研究内容の概要
環境変化が複雑かつ予測困難な状況下での行動戦略にバイアスをかけて対処する認知的柔軟性にフォーカスし、『認知バイアスを介した行動変容の神経回路基盤』を明らかにする。マウスをモデル動物として、マルチカラー内視顕微鏡による局所脳動態イメージング(Ca2+イメージング & FRETイメージング)及び遺伝学的膜電位センサー (genetically-encoded voltage indicator, GEVI) による単一細胞精度の活動電位イメージングによる局所脳動態の解析、覚醒下でのresting-state fMRIによる広域脳動態イメージングを組み合わせて、行動戦略に生じるバイアスの発生メカニズム・スイッチング機構を解明する。長期間の認知課題実施中の局所 (Ca2+イメージング等リアルタイム細胞イメージング及び回路操作) -広域脳動態 (fMRI) をリンクする計測手法・解析手法の開発及びこれらの技術を適用して、自由行動下での行動変容の神経回路基盤を研究する。さらに本領域班員と協働で研究を展開することで本研究領域に貢献する。
文献
- Ohmori H, Hirai Y, Matsui R, Watanabe D. (2023) High resolution recording of local field currents simultaneously with sound-evoked calcium signals by a photometric patch electrode in the auditory cortex field L of the chick. Journal of Neuroscience Methods 392, 109863.
- Hamaguchi K, Takahashi-Aoki H, Watanabe D. (2022) From Retrospective to Prospective: Integrated Value Representation in Frontal Cortex for Predictive Choice Behavior. Proc. Natl. Acad. Sci. U S A 119, e2206067119.
- Okunomiya T, Hioki H, Nishimura C, Yawata S, Imayoshi I, Kageyama R, Takahashi R, Watanabe D. (2019) Generation of a MOR‐CreER knock‐in mouse line to study cells and neural circuits involved in mu opioid receptor signaling. Genesis 58, e23341.
